Revisión
EL CORONAVIRUS SARS-COV-2 O ENFERMEDAD POR COVID-19 Y DIABETES MELLITUS
THE CORONAVIRUS SARS-COV-2 OR COVID-19 DISEASE AND DIABETES MELLITUS
EL CORONAVIRUS SARS-COV-2 O ENFERMEDAD POR COVID-19 Y DIABETES MELLITUS
Revista Venezolana de Endocrinología y Metabolismo, vol. 18, 1, pp. 3-16, 2020
Sociedad Venezolana de Endocrinología y Metabolismo
Recepción: 15 Junio 2020
Aprobación: 15 Julio 2020
Resumen: En diciembre de 2019 en la ciudad de Wuhan, en China, se reportaron los primeros casos de una infección respiratoria por un nuevo coronavirus denominado por la Organización Mundial de la Salud (OMS) como Coronavirus SARS-CoV-2 (Severe Acute Respiratory Syndrome-Coronavirus-2) y la enfermedad que causa se denominó COVID-19. La OMS declaró emergencia internacional el 30 de enero y pandemia el 11 de marzo de 2020. Hasta la fecha se han reportado 12 millones de infectados con más de 600.000 muertes. En este artículo, se hace una revisión del tema, sus mecanismos fisiopatológicos y se responden los interrogantes de si los pacientes con diabetes mellitus tienen mayor susceptibilidad a la infección y mayor probabilidad de complicaciones. Se concluye que la Diabetes Mellitus no aumenta el riesgo de contagio por COVID-19 pero aumenta el riesgo de complicaciones en el paciente con COVID-19 (mortalidad, COVID-19 severo, Síndrome de Distress Respiratorio Agudo (SDRA), lesión aguda renal o cardíaca), sobre todo si existe mal control de la glucemia intrahospitalaria (glucemia >180 mg/dL) o una alta variabilidad glucémica. El mal pronóstico se asocia también con mayor edad y con hipertensión arterial (HTA). La obesidad es el factor de riesgo metabólico más importante para letalidad en pacientes con Covid-19.
Palabras clave: COVID-19, diabetes mellitus, varialilidad glucémica.
Abstract: In December 2019 in the city of Wuhan, Hubei, in China, was informed of cases of pneumonia by a new coronavirus named by the World Health Organization (WHO) as Coronavirus SARS-CoV-2 (Severe Acute Respiratory Syndrome- Coronavirus-2) and the disease it causes was named COVID-19. The WHO declared an international emergency on January 30th and a pandemic on March 11th, 2020. At the moment, 12 million infected have been reported with more than 600,000 deaths. In this article, a review of the topic, its pathophysiological mechanisms is made, and the questions of whether patients with diabetes mellitus have a greater susceptibility to infection and a greater probability of complications are answered. It is concluded that Diabetes Mellitus does not increase the risk of infection by COVID-19 but increases the risk of complications in the patient with COVID-19 (mortality, severe ill-hospitalized patients, Acute Respiratory Distress Syndrome-ARDS, acute kidney or cardiac injury) especially if there is poor control of blood glucose in hospital (blood glucose >180 mg/dL) or high glycemic variability. The poor prognosis is also associated with older age and high blood pressure. Obesity is the most important metabolic risk factor lethality in patients with Covid-19.
Keywords: COVID-19, diabetes mellitus, glycemic variability.
INTRODUCCIÓN
Los coronavirus son una familia de virus que normalmente afectan solamente a animales, pero algunos de ellos también tienen la capacidad de transmitirse de los animales al hombre. Varios coronavirus causan infecciones respiratorias que pueden ir desde el resfriado común hasta enfermedades más graves como el síndrome respiratorio agudo severo (SARS por sus siglas en inglés), que apareció por primera y única vez en 2002 y el síndrome respiratorio de Oriente Medio (MERS), identificado en 2012, con una mortalidad de 10% y 32% respectivamente1.
El coronavirus SARS-CoV-2 (Severe Acute Respiratory Syndrome-Coronavirus-2) es un nuevo tipo que puede afectar a personas, y se detectó por primera vez en diciembre de 2019 en la ciudad de Wuhan, en China. En un 80% de los casos solo produce síntomas leves respiratorios pero con una mayor capacidad de contagio, como se ha visto en todo el mundo, teniendo más de 12 millones de contagiados con más de 600.000 muertes para principios de julio 20202,3.
El mayor número de casos ha ocurrido en Las Américas, Europa, Mediterráneo Oriental, Sudeste pacifico, Pacifico occidental y África. En Latinoamérica se han registrado más de 2.000.000 de casos infectados, estando el mayor número en Brasil, Perú, Chile y México, ubicándose Venezuela en el puesto número 17 para esta fecha, siendo el primer caso diagnosticado el 13 de marzo de 20204.
El virus fue denominado por la OMS como Coronavirus SARS-CoV-2 y la enfermedad que lo causa se denomina COVID-19. La OMS declaró emergencia internacional el 30 de enero y pandemia el 11 de marzo de 20201. Es altamente contagioso siendo la transmisión de persona a persona por medio de las gotas procedentes del tracto respiratorio superior y oral del paciente infectado, y por microgotas o aerosoles que flotan en el aire. Su período de incubación es de 2 a 12 días, y el 50% comienza con síntomas a los 5 días de la transmisión. También se presenta un número importante de portadores asintomáticos desconociéndose hasta los momentos las cifras exactas5.
¿CUÁLES SON LOS MECANISMOS FISIOPATOLÓGICOS?
El virus está formado por 4 proteínas: la espiga (S), la membrana (M), la nucleocápside (N) y la envoltura proteica (E). La proteína S se une al receptor ECA2 (enzima convertidora de la angiotensina 2) el cual se encuentra en el pulmón, intestino, riñón, páncreas y vasos sanguíneos.5,6
El Sistema Renina Angiotensina está constituido por 2 ejes: el eje ACE (siglas en inglés) ó ECA (Enzima convertidora de Angiotensina) – Angiotensina 1-8 (Angiotensina II) – receptor AT1 que determina a nivel del sistema cardiovascular, la vasoconstricción y posterior inflamación, fibrosis y estrés oxidativo. Y el eje ACE 2 o ECA 2 (enzima convertidora de Angiotensina 2), proteína transmembrana que convierte la angiotensina II en angiotensina (1-7), la cual contrarresta el efecto vasoconstrictor y proinflamatorio de angiotensina II. Aunque el ECA 2 ha sido identificado como receptor para la proteína S (spike) del coronavirus – Angiotensina 1-7 - Receptor MAS, este tiene un efecto totalmente contrario de ser anti inflamatorio, anti fibrosis, favorecer la producción de óxido nítrico y la vasodilatación5,6.
Existen altos niveles de ECA2 a nivel pancreático (tanto a nivel endocrino como exocrino) que tienen un papel múltiple antagónico sirviendo como receptor al virus SARS COV2, permitiendo su acceso a nivel tisular y a través del eje Ang 1-7/Mas-R limitar su replicación (Figura 1)6.
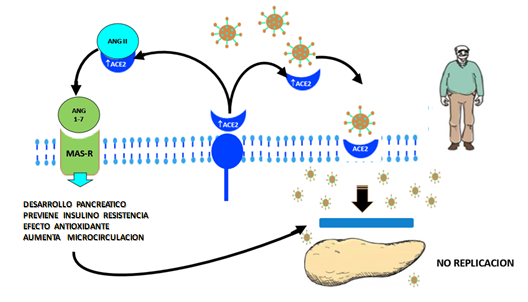
Figura 1
SARS COV2 y el Eje ECA2/Ang 1-7/MAS- R6
Además, patologías como hipertensión, obesidad, insulino resistencia y diabetes mellitus (DM) tipo 2 comparten dos características fundamentales como son la activación del Eje ECA/Ang II /AT1R con aumento de la señal productora de vasoconstricción, estrés oxidativo, fibrosis e inflamación y la inhibición del Eje ECA2/ Ang 1-7/ MAS-R anulando el efecto protector cardiometabólico de esta señal7.
El virus utiliza la serina proteasa de la transmembrana del huésped 2 (TMPRSS2) para el cebado de la proteína S y la fusión de las membranas celulares del virus y de la célula huésped. La respuesta inmunitaria inicial, que implica receptores similares (TTR), el gen inducible de ácido retinoico I (RIGI), los receptores similares a NOD (NLR) y otros sensores de virus en las células epiteliales respiratorias es fundamental para reducir la carga viral y alertar al huésped. La respuesta comienza con el reclutamiento de inmunidad innata. Si la autopropagación viral no es limitada, el creciente número de células epiteliales infectadas y detritus celulares desencadena una liberación masiva de citoquinas, llamada "tormenta de citoquinas", con hiperinflamación e inmunosupresión, caracterizada por un aumento de la actividad citotóxica de Th17 y CD8 y la disminución de la memoria CD4 +T células auxiliares. La respuesta inmunitaria antiviral representa un acto de equilibrio entre la eliminación del virus y la lesión pulmonar inmunitaria. Las células epiteliales infectadas y los desechos unen los receptores de las células inmunitarias, desencadenando la liberación de citoquinas inflamatorias (predominantemente IL-6, IL-1 y TNF alfa) y activando los fibroblastos8.
La propagación viral no controlada induce citotoxicidad desencadenando un círculo vicioso que conduce a la hiperactivación de las células inmunitarias y empeora el estado de hiperinflamación. Todo esto conduce a un estado de hipercoagulabilidad por un imbalance entre el aumento de la actividad de coagulación y una relativa inhibición del sistema fibrinolítico, isquemia, necrosis tisular, estimulación simpática e hipoxia9 .
¿QUÉ SUCEDE EN EL CASO DE HABER HIPERGLUCEMIA E INSULINO RESISTENCIA?
La proteína S (espiga) mediante el receptor ECA2 se une a la membrana celular del huésped. El virus necesita que el receptor sea glucosilado para poder adherirse y penetrar a la célula del huésped, desencadenando un círculo vicioso que conduce a la hiperactivación de las células inmunitarias y empeora el estado de hiper-inflamación10,11.
La hiperglucemia aguda provoca un regulación al alza ¨up regulation¨ de la expresión de ECA 2, lo cual puede facilitar la entrada viral en la célula, pero la hiperglucemia crónica produce una regulación a la baja ¨downregulation¨ de la expresión de ECA 2, dejando las células vulnerables al efecto inflamatorio del virus. Por otra parte, la expresión de ECA 2 en las células β-pancreáticas puede afectar su función de secreción de insulina explicando así casos de cetoacidosis que han sido publicados con un aumento de los requerimientos de insulina y la resistencia a la insulina desactiva el eje Ang1-7/MAS-R potenciando la “tormenta de citoquinas” responsable de la disfunción multiorgánica, propia de esta patología. Esta respuesta es más exagerada en las células endoteliales pulmonares, permitiendo una extravasación de leucocitos al alvéolo, dañándolo posteriormente8,9,12. La variabilidad glucémica aunada a la disfunción endotelial, inflamación vascular y la aterosclerosis preexistente empeorará el pronóstico12.
En el caso de pacientes obesos con DM2, tienen una marcada resistencia a la insulina con un estado de inflamación crónica de bajo grado, una alteración de la respuesta inmune adaptativa y un aumento de la concentración de citoquinas inflamatorias; además un número importante tiene compromiso del volumen pulmonar, mecánica respiratoria y oxigenación12.
Recientemente se han reportado casos de pacientes con cuadros severos de COVID-19 que presentaron debut de DM con hiperglucemias severas, cuadros de cetoacidosis severa con anticuerpos negativos para DM113. Estudios previos en casos de pacientes con infecciones por SARS-Cov1 mostraron inicio de DM hasta 3 años después del cuadro infeccioso. Esto podría explicarse por el daño directo del virus a la célula beta pancreática promoviendo una sobre-expresión de la AngII con una consecuente disminución de secreción de insulina transitoria o prolongada de acuerdo a la severidad de la infección, y las condiciones previas del paciente13.
¿CUÁLES SON LAS MANIFESTACIONES CLÍNICAS?
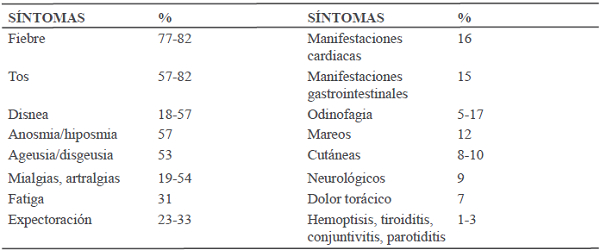
Aproximadamente un 15% de los pacientes tienen la tríada de síntomas de fiebre, tos y disnea, y 90% presentan más de un síntoma (ver tabla I). De los adultos infectados sintomáticos, aproximadamente un 80% presentan síntomas leves o moderados, 15% severos y 5% graves14,15.
Entre los síntomas que caracterizan la infección por Covid-19 se encuentran las manifestaciones cardíacas como síndrome coronario agudo y arritmias en 16% de los casos, insuficiencia cardíaca contribuyendo al 40% de las muertes en general, shock cardiogénico, miocarditis y trombosis. Síntomas gastrointestinales como diarrea, vómitos, dolor abdominal; manifestaciones cutáneas 8-10%, de las cuales pueden ser maculo-papulares 47%, eritema con vesículas y pústulas 19%, erupción vesicular 9% y necrosis/livedo 6%, trastornos neurológicos como cefalea, mareos, manifestaciones de ictus, convulsiones, agitación, delirio, estupor, coma (tabla 1)14.
¿EXISTE ALGUNA CLASIFICACIÓN CLÍNICA?
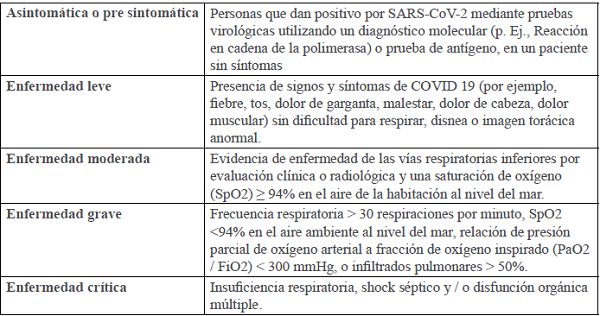
Para el manejo clínico en algunos hospitales de Europa se han identificado cinco diferentes fenotipos de COVID-19 (Tabla II)17
Y el Instituto Nacional de Salud de EUA lo clasifica según la severidad del caso en 5 estadios (Tabla III):
Las complicaciones más frecuentes que ocurren en el Covid-19 son: síndrome de dificultad respiratoria aguda (SDRA) 15-33%, tromboembolismo venoso pulmonar/miembros inferiores (TEP, TEVMI) 2-31%, llegando en algunos reportes hasta el 85% en TEP, siendo asintomáticos de 14-58%. Las complicaciones cardiovasculares se encuentran en el 7 a 20%, caracterizadas por una microangiopatía difusa con trombosis resultando en una miocarditis, cardiomiopatía, miopericarditis, derrame pericárdico, taponamiento cardíaco, arritmias, insuficiencia cardíaca, síndrome coronario agudo, con rápido deterioro y muerte súbita. La insuficiencia renal aguda se observa en 19-34% de los hospitalizados en Unidad de Cuidados Intensivos (UCI) siendo más frecuente cuando necesitan ventilación asistida y un 31% necesitan diálisis9,14,18.
Se han reportado otras complicaciones menos frecuentes como injuria hepática aguda, pancreatitis hasta en un 19% y las complicaciones neurológicas, cuya presentación puede ser enfermedad cerebro vascular isquémica, ataxia, trastornos de la conciencia, neuralgia, convulsiones, meningitis, encefalitis, encefalopatía, mioclonus y síndrome de Guillain-Barré en 36 a 44%, y menos frecuente, shock séptico, coagulación intravascular diseminada, infecciones secundarias nosocomiales, aspergilosis y se han reportado casos de rabdomiólisis, anemia hemolítica autoinmune y tiroiditis subaguda14,18,19. También se ha referido un síndrome inflamatorio multisistémico con características clínicas similares a las de la enfermedad de Kawasaki y el síndrome inflamatorio sistémico en niños (PIMS ) con COVID-1914,20.
¿CUÁLES SON LAS PRUEBAS DIAGNÓSTICAS?
Se han desarrollado tests/pruebas diagnósticos por medio de métodos como la PCR, ELISA, detección de anticuerpos IgM e IgG, detección de antígenos con diferentes grados de sensibilidad y especificidad. Se han identificado así los diferentes estadios de la enfermedad, desconociéndose hasta los momentos si dichos anticuerpos confieren inmunidad y por cuanto tiempo14.
Hay pruebas moleculares que detectan material genético específico del SARS-CoV-2 en muestras respiratorias tales como la RT-PCR con alta sensibilidad y especificidad en estos pacientes, siendo las pruebas esenciales para el diagnóstico de la infección, tanto en pacientes sintomáticos como asintomáticos, con exposición probable al virus, pero tiene falsos positivos en una proporción considerable. La detección de anticuerpos específicos en muestras séricas permite la detección indirecta de la infección, y estos resultados tienen mayor valor para los estudios epidemiológicos que para la práctica clínica14.
El diagnóstico no depende de una sola prueba, sino que es el resultado final de la evaluación de los resultados de diversas pruebas realizadas a un paciente, como las imágenes, los biomarcadores hematológicos, bioquímicos e inflamatorios de laboratorio clínico y pruebas microbiológicas específicas. Las pruebas moleculares, como la RT-PCR son las herramientas diagnósticas con mayor sensibilidad y especificidad en la primera semana desde el inicio de los síntomas, sin embargo, puede haber falsos negativos en una proporción considerable de los pacientes, por lo que a veces el análisis por RT-PCR de una sola muestra respiratoria por paciente no es suficiente para descartar un caso de COVID-19, sobre todo en un paciente sintomático. Los resultados de las pruebas de anticuerpos hay que interpretarlos con precaución debido a la variabilidad de las sensibilidades de las pruebas y a que los anticuerpos específicos muchas veces se empiezan a detectar mucho tiempo después del inicio de los síntomas14,21.
Los exámenes paraclínicos deben incluir según el caso: hemoglobina, hematocrito, formula y contaje de leucocitos, plaquetas, PT, PTT, INR, fibrinógeno, LDH, ferritina, dímero D, PCRus, creatinina, glucemia, albumina, CPK, AST, ALT, bilirrubina, troponina, péptido natriurético N-terminal (NT-proBNP), procalcitonina y búsqueda de coexistencia de otras infecciones como legionella, mycoplasma, entre otras, e infecciones bacterianas secundarias; para ello los hemocultivos y otros cultivos pueden ser necesarios14,21,22. Entre ellos, el bajo contaje de linfocitos apoya el diagnóstico temprano, los niveles elevados de LDH son un factor independiente predictivo de severidad y los niveles elevados o en franco ascenso de Dímero D, son indicadores de trombosis14,21,22.
La radiología de tórax al inicio, en la fase asintomática o sintomática leve, puede parecer normal y no por ello descartarse la enfermedad, para luego tener presencia de imágenes de vidrio deslustrado o esmerilado uni o bilaterales, de predominio periférico, aunque también pueden ser centrales. En algunos casos con crazy paving y con engrosamientos pleurales, menos frecuentemente derrame pleural, o adenopatía, se denominan clínicamente neumonitis. Al progresar, disminuyen las imágenes de vidrio deslustrado y aparecen áreas de consolidación parenquimatosa a menudo con características de una neumonía organizada uni o bilateral, empeorando las imágenes en caso de SDRA14,17,23.
La TAC de tórax se reserva para pacientes hospitalizados donde la radiología aporte poca información. Se han reportado anormalidades en un 97% de los casos. En un meta-análisis con 50,466 pacientes hospitalizados, la evidencia de neumonía por TAC de tórax precedió al resultado positivo de la RT-PCR para SARS-CoV-2. Si hay imágenes sugestivas y la prueba RT-PCR es negativa debe repetirse el test puesto que puede ser un falso negativo, siendo más confiable la clínica y la imagen14.
La Angio TAC de tórax se reserva en el caso de sospecha de tromboembolismo periférico (TEP) cuando hay un dímero D muy elevado inicial o en franco ascenso. El ECG de ingreso para evaluar anormalidades y el ecocardiograma cuando hay sospecha de miocarditis o pericarditis. La TAC o RMN de cráneo se indican dependiendo de las presentaciones clínica neurológicas14,24.
¿CUÁLES SON LOS FACTORES DE RIESGO IDENTIFICADOS?
El contagio se establece de persona a persona con un enfermo, en residencias de ancianos, situaciones donde no haya distanciamiento social como en aglomeraciones de personas, habiendo casos posteriores a eventos sociales. Viajes procedentes de zonas de infección activa con contacto de personas infectadas. Los aspectos a destacar serian1,2,3,14:
Etnicidad: En el Reino Unido se han descrito los casos en 62% raza negra vs 15,5% raza blanca24. En Nueva York, EUA, un estudio de dos hospitales reportó en pacientes hospitalizados 22,8% hispanos, 19,8% afro-americanos,10,2% blancos y 3% asiáticos25.
Edad: En el Reino Unido las edades entre 40 a 63 años tenían mayor riesgo de infección seguido de los mayores de 75 años y luego personas con edades entre 65 a 74 años. En EUA pacientes ≥65 años correspondían a 31% de los casos, con 45% de los hospitalizados y 53% de las admisiones a UCI y 80% de las muertes, con una mayor incidencia de casos severos en edades ≥ 85 años14,24,25.
Sexo: es más frecuentes en hombres, en el Reino Unido los tests positivos fueron más frecuentes en hombres, 52,93% vs las mujeres 47,07%. El hombre tiene más riesgo de enfermedad severa, uso de ventilación mecánica y mortalidad14,24,25.
Comorbilidades: La presencia de comorbilidades aumenta el riesgo de severidad y mortalidad; las más frecuentes son hipertensión arterial (HTA), enfermedad cardiovascular (ECV), obesidad, diabetes mellitus (DM), enfermedad pulmonar obstructiva crónica (EPOC), cáncer, enfermedad renal crónica (ERC) y enfermedad cerebrovascular14,24,25.
En un trabajo observacional prospectivo con más de 20.000 hospitalizados en el Reino Unido, las comorbilidades más frecuentes fueron enfermedad cardiovascular (31%), DM (21%), EPOC (18%) y ERC (16%). Similar, en EUA las más frecuentes fueron ECV (32%), diabetes (30%) y EPOC (18%). Las hospitalizaciones fueron 6 veces más y las muertes 12 veces más en pacientes con comorbilidades. Se estima que el 56% de los adultos con comorbilidades tienen riesgo de requerir hospitalización24,25. La prevalencia de las comorbilidades en pacientes hospitalizados por COVID-19 fue evaluada en el trabajo de Emami y col con un total de 76.993 pacientes de 10 trabajos donde encontró: HTA en 16,37% (IC95%: 10,15-23,65%), ECV en 12,11% (IC95%: 4,40-22,75%), fumador en 12,11% (IC95%: 4,40-22,75%), EPOC en 7,63% (IC95%: 3,83-12,43%), enf. renal crónica en 0,83% (IC95%: 0,37-1,43%) y DM en 7,87% (IC95%: 6,57-9,28%)26. El estudio de Yang y col con 1527 pacientes mostró una mayor prevalencia de complicaciones metabólicas y cardiovasculares como HTA (17,1%, IC95%: 9,9-24,4%), enfermedad cerebrovascular (16,4%; IC95%: 6,6-26,1%) y diabetes mellitus (9,7%; IC95%: 6,9-1,5%)27.
La hipertensión arterial es un factor de riesgo independiente para infección severa y ha sido asociado a mortalidad, SARS, necesidad de asistencia ventilatoria e ingreso a Unidad de Cuidados Intensivos (UCI), teniendo un RR de 2,27 para enfermedad severa y 3,48 para mortalidad28,29.
La obesidad es considerada un problema de salud pública y es un factor de riesgo importante para severidad y mortalidad por COVID-19. El estudio de Lusignan y col en el Reino Unido encontró un mayor riesgo ajustado de tener un test positivo para COVID-19 en población obesa, de 20,9% vs 13,2% en no obesa. La obesidad confiere un riesgo independiente para severidad de la enfermedad y muerte29. El estudio de Klang y col con 3.406 pacientes, se incluyeron 572 sujetos (17%) con edades menores de 50 años; en este grupo, la mortalidad fue de 10,5% vs 38% en el grupo de mayores de 50 años, siendo un factor de riesgo independiente para el grupo más joven el tener el IMC >40Kg/m. (aOR 5,1; IC95%: 2,3-11,1 vs aOR 1,6; IC95%: 1,2-2,3)30.
El estudio Coronado31 realizado en 53 hospitales de Francia con 1317 pacientes con DM hospitalizados por COVID-19 del 10 al 31 de marzo, evaluó las características del fenotipo, y como puntos finales evaluados a los 7 días, la necesidad de ventilación mecánica y muerte. Los pacientes tenían un promedio de edad de 65 años, hombres 65%, HTA 77%, con un índice de masa corporal (IMC) promedio de 28,4 Kg/m., teniendo sobrepeso 37%, obesidad 39% y una HbA1c > 7%, el 71% con un promedio de 8,1%, complicaciones microvasculares 47%, complicaciones macrovasculares 41% y en tratamiento con insulina 38%. El punto final de ventilación mecánica con una n=382 se alcanzó en 29%, siendo en 695 hombres mayores de 70 años, con IMC de 29,1 Kg/m. y una HbA1c de 8,1%. Los factores independientes relacionados con el punto final fueron el IMC anterior al ingreso y el grado de disnea, el contaje de linfocitos, los niveles de AST y la PCRus. El otro punto final evaluado fue la muerte, con una n= 140, eran 69% hombres, con edad promedio de 79 años, con un IMC de 27,7 Kg/m. y HbA1c de 8,1%. Los factores independientes asociados a muerte fueron el IMC anterior a la admisión, la edad y las complicaciones micro y macrovasculares, presencia de síndrome de apnea obstructiva del sueño (SAOS), y en la admisión, el grado de disnea, la fracción renal glomerular (FRG), los niveles de AST, el contaje plaquetario y la PCRus. Los autores concluyeron que la obesidad es el factor de riesgo metabólico más importante para letalidad por COVID-1931.
El obeso con DM2 tiene estado de inflamación crónica de bajo grado, alteración de la respuesta inmune adaptativa y aumento de la concentración de citoquinas inflamatorias, además un número importante, tiene compromiso del volumen pulmonar, mecánica respiratoria y oxigenación29,31,32.
¿SON LOS PACIENTES DIABÉTICOS MÁS SUSCEPTIBLES DE CONTAGIARSE O DE MAYOR SEVERIDAD DEL CUADRO INFECCIOSO?
En los comienzos de la pandemia llamó la atención el mayor número de casos en la población con DM, HTA y obesidad, la pregunta que se hizo fue si esa población es más susceptible de enfermarse o representaban la prevalencia actual tan elevada de dichas enfermedades33.
El metanálisis de Kumar y col de 33 estudios observacionales con 16.003 pacientes con COVID-19, evaluó la prevalencia de DM comparándola con la local. El desenlace primario fue evaluar muerte y severidad de la infección y el segundo desenlace fue la prevalencia de DM en esa población comparada con la prevalencia de DM local. Pacientes diabéticos con COVID-19 tienen doble riesgo de desarrollar casos severos en términos de ingreso a UCI, ventilación mecánica y la mortalidad acumulada fue de OR 1,90 (IC95%: 1,37-2,64; p<0,01). La diabetes estuvo asociado a casos severos, OR acumulado de 2,75 (IC95%: 2,09-3,62; p<0,01). La prevalencia acumulada de diabetes fue de 9,8% (IC95%: 8,7-10,9%), después de ajustarlo por heterogeneidad, la prevalencia acumulada fue de 11,2% (IC95%: 9,5-13,0%), similar a la prevalencia local de 10%34.
Fadini y col realizaron un metanálisis con estudios chinos comparándolo con estudios en Italia, donde reportaron la prevalencia de diabetes en la población infectada versus la prevalencia de DM en la población en general. En los estudios chinos la prevalencia de DM en general fue 10,9 a 12,3% según las regiones y en la población infectada fue de 10,3%; y en el caso de Italia la prevalencia de DM en la región de Padua, una de las más afectadas fue de 6,2 a 11%, y en la población infectada de 8,9%. Cuando se compararon pacientes con enfermedad severa vs con enfermedad leve-moderado, la tasa combinada fue en China de 2,26 (IC95%: 1,47-3,49) y en Italia de 1,75. Basado en estos datos concluyeron que la diabetes no aumenta el riesgo de infección por COVID-19 pero si aumenta el riesgo de severidad y muerte. La prevalencia de casos severos en la población general fue de 18% (13-23%) y en la población con DM fue de 44% (27-62%)35.
La revisión sistemática de 30 estudios de Huang y col, con 6.452 pacientes que tenían COVID-19, evaluó el punto de desenlace compuesto que incluyó muerte, clínica severa, SARS, necesidad de ingreso a UCI y progresión de severidad entre la población general y la subpoblación con DM; concluyeron que la DM está asociada a un peor desenlace compuesto (RR 2,38 [1,88-3,03], p < 0,001; I2: 62%) y en los subgrupos de mortalidad (RR 2,12 [1,44-3,11], p < 0,001; I2: 72%), de casos severos (RR 2,45 [1,79-3,35], SDRA (RR 4,64 [1,86-11,58] y de progresión de enfermedad (RR 3,31 [1.08-10.14], p< 0,04; I2: 0%); se calculó la meta-regresión dando peor pronóstico la asociación con la edad (p=0,003) y la HTA (p<0,001)36.
El Centro para el Control y Prevención de los Estados Unidos (CDC) reportó de forma preliminar que el 10,9% de estos pacientes con COVID-19 tenían antecedente de DM, y fue mucho más común este antecedente entre aquellos hospitalizados (24%) y admitidos en una UCI (32%), que en aquellos que recibieron un tratamiento ambulatorio (6%)3.
¿EXISTE ALGUNA RELACIÓN ENTRE EL CONTROL GLUCÉMICO Y EL RIESGO DE INFECCIÓN SEVERA O MORTALIDAD?
Un gran número de trabajos han demostrado que pacientes con pobre control de la hiperglucemia intrahospitalaria tienen un riesgo incrementado para severidad y mortalidad por COVID-19, más aún si se suman a estos factores la edad avanzada y otras comorbilidades como HTA, obesidad y ECV37,38,39.
En un estudio retrospectivo en 133 pacientes diabéticos con SARS en 2003 se evaluó la relación entre glucemia en ayunas promedio durante su hospitalización y sobrevida, concluyendo que la hiperglucemia sostenida era un predictor de morbimortalidad40, coincidiendo con el hallazgo de Chao y col en pacientes con COVID-19, donde la variabilidad glucémica durante el primer día estaba asociada a mayor mortalidad en UCI41.
En un estudio de cohorte retrospectivo de Zhu y col se hizo seguimiento por 28 días a 7.337 pacientes seleccionados con COVID-19 (18-75 años) en 19 hospitales de la provincia de Hubei (China), de los cuales 952 tenían DM2 (13%). En ellos se estudiaron las características basales de ambos grupos estableciendo diferencias significativas en el grupo con DM, en la edad y las complicaciones como SRAS, injuria renal aguda, injuria cardíaca aguda, shock, infección secundaria. Los pacientes que presentaron valores glucémicos entre 70 y 180 mg/dl durante la hospitalización (HbA1c promedio 7,3%) tuvieron 86% menos mortalidad que quienes mostraron valores sostenidamente por encima de 180 mg/dL (HbA1c promedio 8,1%) (7,8% vs 2,7%; razón de riesgo ajustada [HR] de 1,49). Los pacientes mejor controlados tuvieron menor riesgo de desarrollar elevaciones marcadas de procalcitonina, dímero D o proteína C-reactiva, linfopenia y desarrollar falla renal aguda42.
Otro trabajo que presenta similar observación es el de Bode y col, el cual se hizo con los datos de Glytec (Waltham, MA, United States), una compañía de software para titulación de insulina con 1.122 pacientes de 88 hospitales donde 451 (40%) tenían DM (considerando como diagnóstico una HbA1c ≥6.5%) y/o hiperglucemia no controlada (Glucosa >180 mg/dl) y no DM con una HbA1c <6.5%); resultó que la tasa de mortalidad en el grupo I de DM/hiperglucemia fue de 28,8% vs grupo II no DM 6,2%, siendo el promedio de las glucemias entre el grupo I y II de 70-180 = 59,7% vs 97,8%, glucemias entre 180-250 = 39,1% vs 1,4%, glicemias >250 = 14,6% vs 0,1%, con una HbA1c de 8,5% (±2,3) vs 5,9% (±0,51), y con un promedio de días de estancia en DM/hiperglucemia no controlada de 5,7 vs 4,3 días (p <0,001)43. Estas afirmaciones coinciden con el estudio de Sing y col. en el mismo punto de corte de glucosa <180 mg/dl44, y por ello muchos autores han concluido en la importancia de la variabilidad glucémica como factor de mal pronóstico10,12,19,41,43,44,45,46.
Un estudio retrospectivo realizado en China reportó episodios de hipoglucemia en el 10% de los pacientes con diabetes y COVID-19. La hipoglucemia induce un aumento en la producción de moléculas proinflamatorias, por lo que, al igual que la hiperglucemia, empeora el desenlace clínico de la infección. Esta inflamación metabólica predispone a una liberación aumentada de citoquinas durante el COVID-19, que desencadena una tormenta de citoquinas implicadas en la falla multiorgánica en pacientes con enfermedad grave47.
¿EXISTE ALGUNA RELACIÓN ENTRE LOS MARCADORES INFLAMATORIOS Y LA HBA1C?
En un estudio retrospectivo de Wang y col con 122 pacientes en Wuhan China, se analizó si había asociación entre los niveles de HbA1c, los marcadores inflamatorios e hipercoagulabilidad con el pronóstico de pacientes con COVID-19. Los pacientes se dividieron según los niveles de HbA1c: Grupo A: 5,7% (5,4-5,8), Grupo B: 6,4% (6,2-6,5), Grupo C: 7,55% (7,1-8,7); en cada grupo se evaluaron los niveles de ferritina, PCRus, fibrinógeno, IL-6, VSG; se encontró una progresión de los valores a medida que aumentaban los niveles de HbA1c, y la tasa de mortalidad fue mayor progresivamente siendo en el grupo A de 9,8%, grupo B de 11,4% y en el grupo C de 27,3%9,48.
¿EN CASO DE INFECCIÓN SE DEBE HACER ALGÚN AJUSTE A LOS MEDICAMENTOS PARA DM2?12,36,49,50,51.
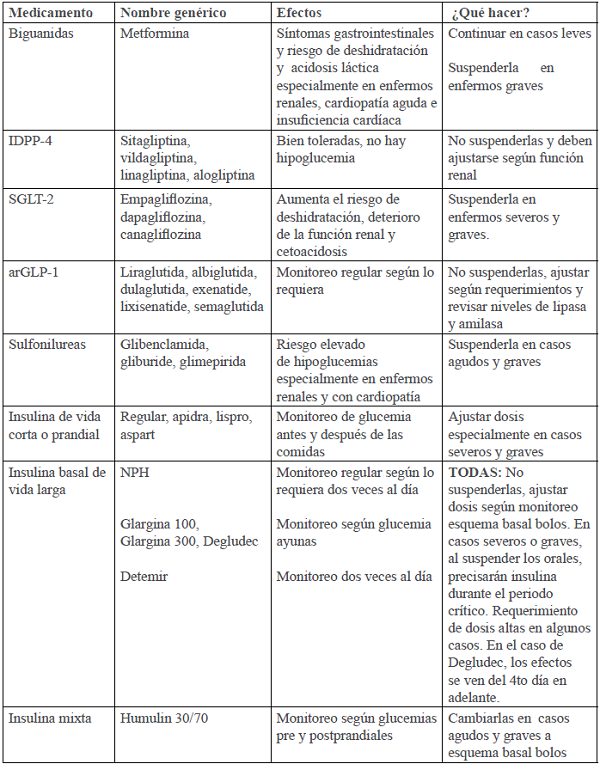
En la tabla IV se resumen los medicamentos para tratamiento de la DM, sus posibles efectos si se presenta COVID-19 y los cambios o ajustes a realizar.
Está en desarrollo el Estudio DARE-19 (Dapagliflozin in respiratory failure in patients with COVID-19), un ensayo clínico de asignación aleatoria, multicéntrico, en grupos paralelos, doble ciego y controlado con placebo en pacientes hospitalizados por COVID-19, donde se evalúa el efecto de la dapagliflozina a 10 mg frente a placebo, durante 30 días, en adición al manejo metabólico de base, sobre la reducción de la progresión, las complicaciones y la mortalidad por todas las causas, se evaluarán pronto sus resultados52.
CONCLUSIÓN
De esta revisión se puede concluir que la Diabetes Mellitus no aumenta el riesgo de contagio por COVID-19, pero aumenta el riesgo de complicaciones en el paciente con COVID-19 (mortalidad, COVID-19 severo, SDRA, lesión aguda renal o cardíaca); el mayor riesgo de complicaciones depende del mal control de la diabetes (glucemia >180 mg/dl), y la variabilidad glucémica es un factor de mal pronóstico. Además, el mal pronóstico en la persona con DM se asocia también con mayor edad y con HTA. La obesidad es el factor de riesgo metabólico más importante para letalidad por covid-19.
REFERENCIAS BIBLIOGRÁFICAS:
1) WHO. Coronavirus disease (COVID-19). Accessed in june 2020. . Available from: https://www.who.int/docs/default-ource/coronaviruse/situation-reports/20200625-covid-19-sitrep-157.pdf?sfvrsn=423f4a82_2
2) Worldometer. COVID-19 coronavirus pandemic (COVID-19). Accessed in june 2020. Available from: https://www.worldometers.info/coronavirus
3) Centers for Disease Control and Prevention (CDC). Coronavirus disease 2019 (COVID-19): Interim clinical guidance for management of patients with confirmed coronavirus disease (COVID-19). Accessed in june 2020. https://www.cdc.gov/coronavirus/2019-ncov/hcp/clinical-guidance.
4) OPS. Situación de COVID-19 en la Región de las Américas. Consultado el 24 de junio de 2020. Disponible en: https://www.paho.org/es/temas/coronavirus/brote-enfermedad-por-coronavirus-covid-19
5) Kumar D, Malviya R, Kumar Sharma P. Corona Virus: A review of COVID-19. EJMO 2020;4:8-25.
6) Gheblawi M, Wang K, Viveiros A, Nguyen Q, Zhong JCH , Turner A, Raizada MK, Grant MB, Oudit GY. Angiotensin converting enzyme 2: SARS-CoV-2 receptor and regulator of the renin-angiotensin system: celebrating the 20th anniversary of the discovery of ACE2. Circ Res 2020;126:1456-1474.
7) Liu F, Long X, Zhang B, Zhang W, Chen X, Zhang Z. ACE2 expression in pancreas may cause pancreatic damage after SARS-CoV-2 infection. Clin Gastroenterol Hepatol 2020;18:2128-2130.
8) Graus-Nunes F, Souza-Mello V. The renin-angiotensin system as a target to solve the riddle of endocrine pancreas homeostasis. Biomed Pharmacother 2019;109:639-645.
9) Wang Z, Du Z, Zhu F. Glycosylated hemoglobin is associated with systemic inflammation, hypercoagulability, and prognosis of COVID-19 patients. Diabetes Res Clin Pract 2020. doi: 10.1016/j.diabres.2020.108214.
10) Ceriello A. Hyperglycemia and the worse prognosis of COVID-19. Why a fast blood glucose control should be mandatory. Diabetes Res Clin Pract 2020;163. doi: 10.1016/j.diabres.2020.108186
11) Muniyappa R, Gubbi S. COVID-19 pandemic, coronaviruses, and diabetes mellitus. Am J Physiol Endocrinol Metab 2020;318:E736-E741.
12) Apicella M, Campopiano MC, Mantuano M, Mazoni L, Coppelli A, Del Prato S. COVID-19 in people with diabetes: understanding the reasons for worse outcomes. Lancet Diabetes Endocrinol 2020. DOI:https://doi.org/10.1016/S2213-8587(20)30238-2
13) Chee YJ, Huey Ng SJ, Yeoh E. Diabetic ketoacidosis precipitated by Covid-19 in a patient with newly diagnosed diabetes mellitus. Diabetes Res Clin Pract 2020;164:108166. doi: 10.1016/j.diabres.2020.108166.
14) BMJ Best Practice. Coronavirus disease 2019 (COVID-19). Last updated: Jun 11, 2020. Accessed 12 june 2020. Available in: https://bestpractice.bmj.com/ el 12 de junio de 2020
15) Epidemiology Working Group for NCIP Epidemic Response, Chinese Center for Disease Control and Prevention. The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) in China. Zhonghua Liu Xing Bing Xue Za Zhi 2020;41:145-151.
16) Galvan Casas C, Catala A, Carretero Hernández G, Rodríguez-Jimenez P, Fernandez-Nieto D, Rodrıguez-Villa A, Navarro Fernandez I, Ruiz-Villaverde R, Falkenhain D, Llamas Velasco M, et al. Classification of the cutaneous manifestations of COVID-19: a rapid prospective nationwide consensus study in Spain with 375 cases. Br J Dermatol 2020. Doi:10.1111/bjd.19163.
17) Gobierno de España, Ministerio de Sanidad. Documento técnico. Manejo clínico del COVID-19: atención hospitalaria. Madrid junio 2020. Accesado en junio 2020. Disponible en: https://www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov-China/documentos/Protocolo_manejo_clinico_ah_COVID-19.pdf.
18) Cummings MJ, Baldwin MR, Abrams D, Jacobson SD, Meyer BJ, Balough EM, Aaron JG, Claassen J, Rabbani LE, Hastie J, et al. Epidemiology, clinical course, and outcomes of critically ill adults with COVID-19 in New York City: a prospective cohort study. Lancet 2020;395:1763-1770.
19) Brancatella A, Ricci D, Viola N, Sgrò D, Santini F, Latrofa F. Subacute thyroiditis after Sars-COV-2 infection. J Clin Endocrinol Metab 2020;105:1-4.
20) Verdoni L, Mazza A, Gervasoni A, Martelli L, Ruggeri M, Ciuffreda M, Bonanomi E, D'Antiga L. An outbreak of severe Kawasaki-like disease at the Italian epicentre of the SARS-CoV-2 epidemic: an observational cohort study. Lancet 2020;395:1771-1778.
21) Garg S, Kim L, Whitaker M, O'Halloran A, Cummings CH, Holstein R, Prill M, Chai SJ, Kirley PD, Alden NB, et al. Hospitalization rates and characteristics of patients hospitalized with laboratory-confirmed COVID19. MMWR 2020;69:458-464.
22) Carvajal AC, Peña SO, Esparza J, Bacci S, Castro J, Lugo Peña J, Annunziato MA, Rísquez A, Fernández M, Oletta López JF, et al. COVID-19: Estado del arte, Primera parte (Informe preliminar). Red Defendamos La Epidemiología Nacional (RDEN). Gaceta Médica de Caracas 2020 (en prensa).
23) Shi H, Han X, Jiang N, Cao, Alwalid O, Gu J, Fan Y, Zheng CH. Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. Lancet Infect Dis 2020;20:425-434.
24) Docherty AB, Harrison EM, Green CA, Hardwick HE, Pius R, Norman L, Holden KA, Read JM, Dondelinger F, Carsonet G, et al. Features of 20 133 UK patients in hospital with covid-19 using the ISARIC WHO clinical characterisation protocol: prospective observational cohort study. BMJ 2020;369:m1985. http://dx.doi.org/10.1136/bmj.m1985.
25) Belanger M, Hill MA, Angelidi AM, Dalamaga M, Sowers JR, Mantzoros CS. Covid-19 and disparities in nutrition and obesity. N Eng J Med 2020. DOI: 10.1056/NEJMp2021264
26) Emami A, Javanmardi F, Pirbonyeh N, Akbari A. Prevalence of underlying diseases in hospitalized patients with COVID-19: a systematic review and meta-analysis. Arch Acad Emerg Med 2020;8:e35.
27) Yang J, Zheng Y, Gou X, Pu K, Chen Z, Guo Q, Ji R, Wang H, Wang Y, Zhou Y. Prevalence of comorbidities and its effects in patients infected with SARS-CoV-2: a systematic review and meta-analysis. Int J Infect Dis 2020;94:91-95.
28) Bo L, Yang J, Zhao F, Zhi L, Wang X, Liu L, Bi Z, Zhao Y. Prevalence and impact of cardiovascular metabolic diseases on COVID-19 in China. Clin Res Cardiol 2020;109:531-538.
29) de Lusignan S, Dorward J, Correa A, Jones N, Akinyemi O, Amirthalingam G, Andrews N, Byford R, Dabrera G, Elliot A, et al. Risk factors for SARS-CoV-2 among patients in the Oxford Royal College of General Practitioners Research and Surveillance Centre primary care network: a cross-sectional study. Lancet Infect Dis 2020. https://doi.org/10.1016/S1473-3099(20)30371-6.
30) Klang E, Kassim G, Soffer S, Freeman R, Levin MA, Reich D. Morbid obesity as an independent risk factor for COVID-19 mortality in hospitalized patients younger than 50. Obesity 2020. https://doi.org/10.1002/oby.22913.
31) Cariou B, Hadjadj S, Wargny M, Pichelin M, Al-Salameh A, Allix I, Amadou C, Arnault G, Baudoux F, Bauduceau B, et al. Phenotypic characteristics and prognosis of inpatients with COVID-19 and diabetes: the CORONADO study. Diabetologia 2020;63:1500-1515.
32) Kassir R. Risk of COVID-19 for patients with obesity. Obes Rev 2020;21:e13034. doi: 10.1111/obr.13034.
33) Wang X, Wang S, Sun L, Qin G. Prevalence of diabetes mellitus in 2019 novel coronavirus: a meta-analysis. Diabetes Res Clin Pract. 2020;164. doi: 10.1016/j.diabres.2020.108200
34) Kumar A, Arora A, Sharma P, Anikhindi SA, Bansal N, Singla V, Khare S, Srivastava A. Is diabetes mellitus associated with mortality and severity of COVID-19? A meta-analysis. Diabetes Metab Syndr 2020;14:535-545.
35) Fadini GP, Morieri ML, Longato E, Avogaro A. Prevalence and impact of diabetes among people infected with SARSCoV-2. J Endocrinol Invest 2020. doi: 10.1007/s40618-020-01236-2.
36) Huang I, Lim MA, Pranata R. Diabetes mellitus is associated with increased mortality and severity of disease in COVID-19 pneumonia - A systematic review, meta-analysis, and meta-regression. Diabetes Metab Syndr 2020;14:395-403.
37) Chen Y, Yang D, Cheng B, Chen J, Peng A, Yang Ch, Liu Ch, Xiong M, Deng A, Zhang Y, Zheng L, and Huang L. Clinical characteristics and outcomes of patients with diabetes and COVID-19 in association with glucose- lowering medication. Diabetes Care 2020;43:1399-1407
38) Wu J, Huang J, Zhu G, Wang Q, Lv Q, Huang Y, Yu Y, Si X, Yi H, Wang C, et al. Elevation of blood glucose level predicts worse outcomes in hospitalized patients with COVID-19: a retrospective cohort study. BMJ Open Diabetes Res Care 2020;8. doi: 10.1136/bmjdrc-2020-001476
39) Li H, Tian S, Chen T, Cui Z, Shi N, Zhong X, Qiu K, Zhang J, Zeng T, Chen L, et al. Newly diagnosed diabetes is associated with a higher risk of mortality than known diabetes in hospitalized patients with COVID-19. Diabetes Obes Metab 2020. doi: 10.1111/dom.14099
40) Yang JK, Feng Y, Yuan MY, Yuan SY, Fu HJ, Wu BY, Sun GZ, Yang GR, Zhang XL, Wang L, et al. Plasma glucose levels and diabetes are independent predictors for mortality and morbidity in patients with SARS. Diabet Med 2006;23:623-628.
41) Chao WCH, Tseng CH, Wu CHL, Shih SJ, Yi CHY, Chan MCH. Higher glycemic variability within the first day of ICU admission is associated with increased 30‑day mortality in ICU patients with sepsis. Ann Intensive Care 2020;10:17. https://doi.org/10.1186/s13613-020-0635-3
42) Zhu L, She ZG, Cheng X, Qin JJ, Zhang XJ, Cai J, Lei F, Wang H, Xie J, Wang W, et al. Association of blood glucose control and outcomes patients with COVID-19 and pre-existing type 2 diabetes. Cell Metabolism 2020;31:1068-1077.
43) Bode B, Garrett V, Messler J, McFarland R, Crowe J, Booth R, Klonoff DC. Glycemic characteristics and clinical outcomes of COVID-19 patients hospitalized in the United States. J Diabetes Sci Technol 2020;14:813-821.
44) Singh AK, Singh R. Does poor glucose control increase the severity and mortality in patients with diabetes and COVID-19? Diabetes Metab Syndr. 2020;14:725-727.
45) Riddle MC, Buse JB, Franks PW, Knowler WC, Ratner RE, Selvin E, Wexler DJ, Kahn SE. COVID-19 in people with diabetes: urgently needed lessons from early reports. Diabetes Care 2020;43:1378-1381.
46) Sardu C, D’Onofrio N, Balestrieri ML, Barbieri M, Rizzo MR, Messina V, Maggi P, Coppola N, Paolisso G, Marfella R. Outcomes in patients with hyperglycemia affected by COVID-19: can we do more on glycemic control? Diabetes Care 2020;43:1408-1415.
47) Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall R, Manson JJ, HLH Across Speciality Collaboration, UK. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet 2020;395:1033-1034.
48) Wang F, Nie J, Wang H, Zhao Q, Xiong Y, Deng L, Song S, Ma Z, Mo P, Zhang Y. Characteristics of peripheral lymphocyte subset alteration in COVID-19 pneumonia. J Infect Dis 2020;221:1762-1769.
49) Bornstein SR, Rubino F, Khunti K, Mingrone G, Hopkins D, Birkenfeld AL, Boehm B, Amiel A, Ig Holt R, Skyler JS, et al. Practical recommendations for the management of diabetes in patients with COVID-19. Lancet Diabetes Endocrinol 2020;8:546-550.
50) Ceriello A, Standl E, Catrinoiu D, Itzhak B, Lalic NM, Rahelic D, Schnell O, Skrha J, Valensi P, on behalf of the Diabetes and Cardiovascular Disease (D&CVD) EASD Study Group. Issues of cardiovascular risk management in people with diabetes in the COVID-19 era. Diabetes Care 2020;43:1427-1432.
51) Drucker DJ. Coronavirus infections and type 2 diabetes - shared pathways with therapeutic implications. Endocrine Reviews 2020. doi: 10.1210/endrev/bnaa011.
52) Saint Luke's Health System. Dapagliflozin in respiratory failure in patients with COVID-19 (DARE-19). ClinicalTrials.gov Identifier: NCT04350593. Accessed in july 2020. Available in: https://clinicaltrials.gov/ct2/show/NCT04350593.