Experiencia en el tratamiento del cáncer ovárico avanzado
Experiencia en el tratamiento del cáncer ovárico avanzado
Revista Venezolana de Oncología, vol. 29, núm. 4, pp. 232-243, 2017
Sociedad Venezolana de Oncología

Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial-CompartirIgual 4.0 Internacional.
Recepción: 26 Mayo 2017
Revisado: 12 Julio 2017
Aprobación: 20 Agosto 2017
Resumen: Siendo el cáncer de ovario una patología maligna ginecológica frecuente y con alta mortalidad, y el no contar con autoevaluación del tratamiento ofrecido en ésta institución, motivó la realización de la presente investigación. OBJETIVO: Determinar la experiencia del tratamiento en el cáncer ovárico avanzado en el Instituto Autónomo Hospital Universitario de Los Andes en el período comprendido entre enero 2002 y diciembre 2006. MÉTODO: Investigación descriptiva y retrospectiva. Muestra: 54 pacientes con cáncer ovárico avanzado. Por observación, se aplicó un instrumento de recolección de datos iniciales, antecedentes, clínicos, paraclínicos, de tratamiento quirúrgico y adyuvante. La información fue organizada en una base de datos, se utilizó SPSS 20.0, obteniendo números absolutos, porcentaje y medias. Los resultados se organizaron en figuras y cuadros, considerándose significancia estadística P<0,05. RESULTADOS: Edad media 50 años, el origen epitelial estuvo presente en 89,8 %, el promedio de CA125 fue 315,61U/l, fueron operadas el 90,74 %, recibieron adyuvancia un 96,3 %. Se observó experiencia importante con cirugía de intervalo y citorreducción secundaria, lograron optimización del 70 % y 63,63 % respectivamente, sólo recidivaron en 30 % y 18,18 % respectivamente, y con pocas complicaciones peri-operatorias. CONCLUSIONES: La gran mayoría de las pacientes recibieron el tratamiento estándar para cáncer de ovario. La cirugía de intervalo y citorreducción secundaria resultó ser una gran opción de tratamiento para las pacientes en donde se dificulte la citorreducción óptima primaria.
Palabras clave: Cáncer, ovario, quimioterapia, cirugía, intervalo, secundaria.
Abstract: Being the cancer of ovary a malignant gynecological frequent pathology and with high mortality, and not relying on evaluation of the treatment offered in this institution, it motivated the accomplishment of the present research. OBJECTIVE: To determine the experience of treatment in advanced ovarian cancer at the Autonomic Institute University Hospital University of Los Andes in the period between January 2002 and December 2006. METHOD: Descriptive and retrospective research. It sample: 54 patients with advanced ovarian cancer. For observation, there was applied an instrument of compilation of initial information, precedents, clinical, laboratory, of surgical treatment and adjuvant therapy. The information was organized in a database; SPSS 20.0 was used, obtaining absolute numbers, percentage and averages. The results organized figures and tables, being considered significant statistics P<0.05. RESULTS: Age mediates 50 years, the epithelial origin was present in 89.8 %, the average of CA125 was 315,61U/l, was operated 90.74 %, received adjuvant a 96.3 %. Important experience was observed with interval surgery and secondary cytoreduction, succeeded a grade optimum the 70 % and 63.6 % respectively, only recurred in 30 % and 18.18 % respectively, and with few perioperative complications. CONCLUSIONS: The great majority of the patients received the standard treatment to ovarian cancer. The interval surgical and secondary cytoreduction, turner out to be a great option of treatment for the patients in where primary cytoreductive surgery becomes difficult.
Keywords: Cancer, ovary, chemotherapy, surgery, interval, secondary.
INTRODUCCIÓN
El ovario es un órgano muy complejo, tanto embriológica e histológicamente como funcional. Por ello, el ovario puede ser asiento de numerosos tumores de muy distinto rango morfológico, algunos de los cuales están dotados de función hormonal (1,2.3).
El riesgo que tiene una mujer al nacer de padecer cáncer ovárico en algún momento es de 1 en 70 (1,4 %) y el de morir por esta causa es de casi 1 % (4). El cáncer epitelial ovárico tiene su mayor representación a partir de los 50 años, siendo la edad media 49,6 años de edad (1). En Venezuela el mayor número de fallecimientos por cáncer ovárico para el año 2005 fue entre 60 y 64 años de edad, representando 14,36 % (52 muertes) de todas las ocurridas por ésta causa (5). En año 2005 en Venezuela ocurrieron 362 muertes por cáncer ovárico, de las cuales 17 correspondieron al estado Mérida, ocupando en ambos territorios el cuarto lugar de fallecimientos entre los cánceres ginecológicos (5).
El cáncer ovárico más frecuente es el epitelial: 85 %-90 % de casos (1,6). Se clasifica según la Federación Internacional de Ginecología y Obstetricia (FIGO), basado en los hallazgos durante cirugía, definiendo los estadios de cáncer ovárico avanzado: estadio III tumor puede afectar a uno o dos ovarios, presenta implantes peritoneales fuera de la pelvis y/o ganglios linfáticos positivos; el estadio IV existencia de metástasis a órganos distantes(1,4). El tratamiento del carcinoma ovárico es básicamente quirúrgico, se han añadido métodos coadyuvantes como quimioterapia principalmente y radioterapia en menor medida, debido al hecho de que la mayoría se descubre en estadios avanzados(7,8).
La cirugía en el cáncer de ovario es, siempre que sea posible, radical, intentando extirpar la totalidad del tumor, así como útero, epiplón, apéndice, ganglios pélvicos y para-aórticos y realizar biopsias múltiples, estudio del líquido ascítico o lavado peritoneal, biopsia diafragmática etc. Esto no sólo con fines curativos sino de estadificación e instauración correcta de tratamiento adyuvante posterior (9). Si se sospecha masa anexial maligna, el abordaje inicial debe ser por laparotomía. El uso de la laparoscopia debe quedar para pacientes seleccionadas y en manos de un cirujano entrenado en ginecología oncológica y/o para evaluar irresecabilidad (1,10).
Aun se siguen evaluando opciones terapéuticas en aquellos pacientes en los que no se logre o se pronostique no lograr citorreducción completa, o bien citorreducción óptima: enfermedad residual menor de 1 cm durante cirugía primaria (1,8,10,11,12,13). Las pacientes cuya enfermedad se extirpó por completo tienen el mejor pronóstico y cerca de 60 % de ellas estarán libres de enfermedad a los 5 años (14).
Cirugía de intervalo sigue planteándose como una alternativa para pacientes en los cuales la citorreducción primaria óptima es improbable (1,8,12,13). La citorreducción secundaria también se ha propuesto como opción terapéutica en pacientes que no puedan, en razón de su estado general, lograrse citorreducción primaria óptima, antes de la poliquimioterapia (1,15,16,17). Entre las ventajas: un mejor estado nutricional, carga tumoral menor y riesgo quirúrgico más bajo en la paciente (11). La primera acción del equipo quirúrgico es establecer la irresecabilidad o no de la masa tumoral, sin embargo, ninguno de los criterios descritos presenta un 100 % de sensibilidad (1,18).
La quimioterapia sistémica combinada ha sido y sigue siendo el tratamiento adyuvante estándar para el tratamiento del cáncer ovárico epitelial metastásico (1,19,20).
Consideramos de suma importancia describir como ha sido la experiencia en el tratamiento ofrecido a las pacientes con cáncer de ovario avanzado, a fin de poder evaluar y determinar en un futuro cuales son las mejores alternativas para mejorar la sobrevida de dichas mujeres, además comparar con series publicadas los resultados obtenidos en nuestra población y poder llegar a protocolizar las pautas que ofrezcan mejores beneficios. También luego de una revisión exhaustiva no se encontraron publicaciones con pacientes tratadas en hospitales fuera de la capital venezolana. Mayor aún es el valor de éste trabajo cuando las pacientes de nuestro hospital han recibido terapia para ésta patología, correspondiente a quimioterápicos de última generación para el momento de su tratamiento y procedimientos quirúrgicos como la cirugía de intervalo que hace pocos años atrás no se realizaban en nuestra región y obviamente no han sido descritos
OBJETIVO
Determinar la experiencia del tratamiento en cáncer ovárico avanzado en el Instituto Autónomo Hospital Universitario de Los Andes entre enero 2002 y diciembre 2006.
MÉTODO
Se realizó una investigación de tipo descriptiva y retrospectiva, permitiendo determinar la experiencia del tratamiento en cáncer ovárico avanzado en el Instituto Autónomo Hospital Universitario de Los Andes (IAHULA) entre 01 de enero 2002 y 31 de diciembre 2006. La muestra constituida por la totalidad de las pacientes que presentaron cáncer de ovario avanzado (III o IV) y que fueron tratadas quirúrgicamente y/o con tratamiento adyuvante.
Se recibió autorización formal para revisión de las historias médicas del personal de archivo del IAHULA. Se implementó el instrumento de recolección con datos iniciales, antecedentes, clínicos, paraclínicos, de tratamiento quirúrgico y adyuvante por técnica de observación, manteniéndose confidencialidad de identificación de las pacientes.
Los datos fueron analizados con SPSS 20.0; utilizándose test exacto de Fisher y/o método de Chi2 con corrección de Pearson para variables cualitativas y Tabla de ANOVA para variables cuantitativas, considerándose valores significativos si P<0,05.
RESULTADOS
Se revisaron un total de 105 historias, que fueron clasificadas según archivo de historias médicas del IAHULA como cáncer de ovario, descartándose 37 por ser estadios precoces y 14 por corresponder a patología de otros órganos abdominopélvicos, finalmente se procesó los datos correspondientes a 54 casos que constituyen el total de pacientes estudiadas en la muestra.
En el período comprendido de enero 2002 a diciembre 2006, se diagnosticó y trató de 1 020 pacientes con cáncer ginecológico (mama, vulva, vagina, cuello uterino, endometrio y ovario) en nuestra institución, ocupando el cáncer ovárico el tercer puesto con 8,95 % (91 casos), estando de primero el cáncer cervical uterino 46,27 % (472 casos), seguido por el cáncer mamario con 35,29 % (360 casos). El cáncer ovárico en estadios tardíos, representó el 5,29 % de la totalidad de los tumores malignos ginecológicos.
Se revisaron un total de 105 historias, que fueron clasificadas según archivo de historias médicas del IAHULA como cáncer de ovario, descartándose 37 por ser estadios precoces y 14 por corresponder a patología de otros órganos abdominopélvicos, finalmente se procesó los datos correspondientes a 54 casos que constituyen el total de pacientes estudiadas en la muestra.
En el período comprendido de enero 2002 a diciembre 2006, se diagnosticó y trató de 1 020 pacientes con cáncer ginecológico (mama, vulva, vagina, cuello uterino, endometrio y ovario) en nuestra institución, ocupando el cáncer ovárico el tercer puesto con 8,95 % (91 casos), estando de primero el cáncer cervical uterino 46,27 % (472 casos), seguido por el cáncer mamario con 35,29 % (360 casos). El cáncer ovárico en estadios tardíos, representó el 5,29 % de la totalidad de los tumores malignos ginecológicos.
El grupo etario con más pacientes fue 50 a 59 años, 18 casos, correspondiendo al 33,3 %. La media de edad: 50 años. Según tipo histopatológico de origen, las edades medias fueron 51,18 años para los epiteliales y 28,20 años para los de origen germinal (P<0,001).
El IMC en el 50 % (23/46) de los casos fue normal sin embargo, se halló un 34,8 % (16/46) de las mismas en sobrepeso; los extremos bajo peso y obesidad no se hallaron destacados en estas pacientes.
La estirpe epitelial con un 89,8 % (44/49) y de los germinales se halló un 10,2 % (5/49). En el subgrupo epitelial el más encontrado fue adenocarcinoma seroso con un 77,27 % (34/44).
CA125 promedio de toda la muestra fue 315,61U/l. El valor promedio del CA125 según origen histológico fue 374,47U/L para los epiteliales, mientras que para los germinales fue 96,61U/L. El marcador AFP arrojó un valor promedio entre los germinales de 220,60 mU/mL y para los epiteliales un valor de 2,64mU/mL (P<0,006).
A 49 de las 54 pacientes estudiadas se les practicó tratamiento quirúrgico, lo que equivale a un 90,74 %.
En aquellas pacientes que se les practicó tratamiento quirúrgico como primera intención, se logró en 46,16 % (18/39) realizar una citorreducción óptima; y un 53,84 % (21/39) citorreducción sub-óptima. El 18,51 % (10/54) fueron considerados irresecables inicialmente, recibiendo quimioterapia neoadyuvante, con previa confirmación histopatológica en todas estas pacientes (Figura 1).
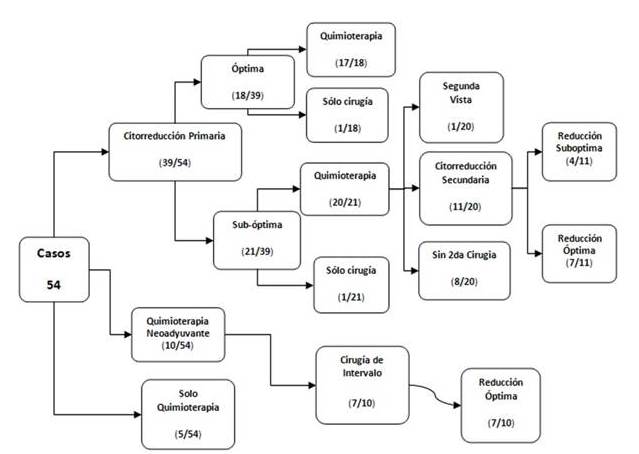
Figura 1
Flujograma de tratamiento.
De la estadificación según FIGO, se obtuvo que el estadio III resaltó con un 81,48 % (44/54), y a su vez el estadio IIIc fue el más frecuente de todos los cáncer avanzados con 59,25 % (32/54) y al estadio IV correspondió un 18,51 % (10/54).
Del total de 54 pacientes, hubo 5 (9,26 %) de ellas que no fueron operadas, sino que en base a varios parámetros como: evolución clínica de aumento de volumen abdominal de menos de 3 meses, con masa pélvica dura, no móvil, con grandes volúmenes de ascitis, CA 125 muy elevado, posmenopáusicas e imágenes compatibles con tumoración anexial con infiltración a otros órganos (irresecabilidad), una de ellas con dificultad respiratoria y citología de líquido pleural positivo para malignidad, fueron diagnosticadas y tratadas como cáncer ovárico a base de quimioterapia; después de la quimioterapia no hay más datos en la historia acerca de la evolución de esas pacientes (Figura 1). De estas pacientes que no fueron intervenidas quirúrgicamente, 80 % (4/5) eran estadio IV y el 20 % (1/5) fueron estadio IIIc.
En los estadios IV, se observó con respecto a la cirugía inicial, que a un 16,70 % (1/6) se le realizó una citorreducción óptima, al 50 % (3/6) de ellos se le realizó, una citorreducción sub-óptima y un 33,30 % (2/6) no era resecable en un primer intento quirúrgico.
A su vez vemos que de los estadios III, el 81,40 % (35/43) pudo ir a una citorreducción, distribuyéndose así: 39,53 % (17/43) óptima y 41,86 % (18/43) sub-óptima; sólo un 18,61 % (8/43) resultó irresecable inicialmente.
No se halló gran diferencia en cuanto al tipo de cirugía utilizada, en relación al índice de masa corporal (IMC) de la paciente (n = 43) (Cuadro 1).
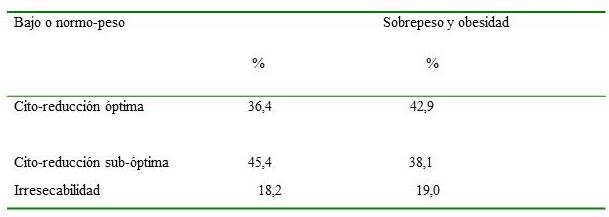
Cuadro 1
Pacientes según cirugía inicial e IMC.
Un 51,02 % de las pacientes fueron clasificadas como de riesgo quirúrgico ASA 2 (25/49), el 40,81 %(20/49) ASA 1 y un 8,17 % (4/49) ASA 3.
Al relacionar el riesgo quirúrgico con el tipo de cirugía primaria llevada a cabo, se pudo observar que predominaron las pacientes pertenecientes al grupo de ASA 2 cuando las cirugías fueron una citorreducción optima o sub-óptima, con 61,10 % (11/18) y 52,40 % (11/21) respectivamente, sin embargo, en aquellas que se consideraron irresecables inicialmente, el riesgo quirúrgico que predomina es ASA 1 con 60 % (6/10) (Figura 2).
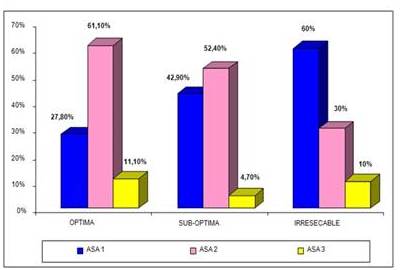
Figura 2
Pacientes según riesgo asa y citorreducción.
Se reportó sólo 2,56 % (1/39) paciente con una complicación transoperatoria (ruptura de quiste del mesenterio), que se presentó en estadio IIIc y que resultó en citorreducción primaria sub-óptima. Un 10,25 % (4/39) presentaron complicación posoperatoria, siendo estas posterior a cito-reducciones primarias que resultaron ser sub-óptimas: 1 hemoperitoneo, 1 obstrucción intestinal y 1 trombo-embolismo pulmonar en estadio IIIc; 1 ascitis + dolor intenso de difícil manejo en estadio IV. Cito-reducciones primarias óptimas no se asociaron a complicaciones transoperatorios ni posoperatorias.
Las pacientes que recibieron tratamiento adyuvante totalizaron un 96,3 % (52/54). Las 2 pacientes no incluidas en tratamiento adyuvante: 1 se negó a recibir el mismo después de su cirugía y otra, 4 meses después de la cirugía no había iniciado la quimioterapia sin explicarse la razón y luego no hay más datos en la historia. El tratamiento en el 100 % (52/52) de los casos fue a base de quimioterapia. Sólo 2 pacientes recibieron radioterapia en conjunto a su esquema de antineoplásicos. De aquellas que recibieron quimioterapia, un 71,15 % (37/52) lo hizo después de la primera cirugía y un 9,61 % (5/52) la recibió como tratamiento único, además un 19,23 % (10/52) recibió la quimioterapia como neoadyuvante (Figura 1).
El número de ciclos cumplido osciló entre 2 y 9, siendo el número de ciclos más frecuente 6, que representó un 40 % (20/50). Las 2 pacientes faltantes para completar 52, que es el total de las que recibieron quimioterapia no se tienen datos acerca del número de ciclos.
Los fármacos utilizados fueron carboplatino, cisplatino, paclitaxel, ciclofosfamida, en varias combinaciones; y de ellas la más utilizada fue carboplatino + ciclofosfamida con un 53,06 % (26/49), que en 2 ocasiones se le agregó además el paclitaxel; seguido de la combinación cisplatino + paclitaxel con 18,40 % (9/49) y el paclitaxel + carboplatino representó un 14,30 % (7/49) (Figura 3). De las 52 que recibieron quimioterapia, hay 3 de las cuales no se tiene especificación, de la combinación de antineoplásicos. Las combinaciones antes mencionadas fueron aplicadas para los cánceres de origen epitelial, que fueron los más frecuentes, cabe destacar que para aquellos de origen germinal se usó otro tipo de fármacos, dentro de los cuales estuvieron bleomicina y etopósido.
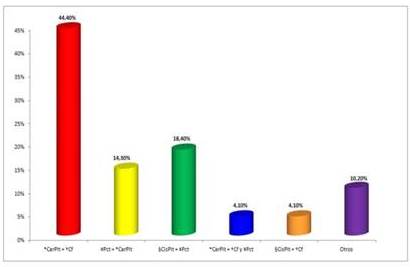
Figura 3
Pacientes según esquema antineoplásico.
*CarPlt: carboplatino. †Cf: ciclofosfamida. ‡Pct: paclitaxel. §cisplt: cisplatino.
La respuesta observada en estirpe epitelial en cuanto al tratamiento con quimioterapia, fue de un 86,36 % para las que tuvieron una buena respuesta, vs. 13,64 % de aquellas en las que no se logró ninguna mejoría (n = 44). La totalidad de los cánceres germinales presentaron buena respuesta (5 casos). No se encuentra diferencia en cuanto a la respuesta a la quimioterapia y el tipo de cirugía primaria.
De las pacientes que inicialmente se clasificaron como improbable la optimización citorreductora primaria, un 70 % (7/10) le fue practicada una cirugía del intervalo y en todas (7/10) resultó con residuo tumoral menor a 1 cm (Figura 1). En tres (3/10) pacientes no se encontró en sus historias datos adicionales y posteriores a la quimioterapia neoadyuvante.
Del total de pacientes en que fue sub-óptima la citorreducción primaria 53,84 % (21/39), el 95,24 % (20/21) fue a tratamiento adyuvante quimioterápico, posterior al cual, 55 % (11/20) se le realizó citorreducción secundaria, lográndose en 63,63 % (7/11) de ellas residuo tumoral menor de 1cm (Figura 1).
El residuo tumoral óptimo se logró en 46,16 % (18/39) posterior a citorreducción primaria; 63,63 % (7/11) posterior citorreducción secundaria; y 70 % (7/10) en cirugía del intervalo (Figura 1).
Diez pacientes de las 49 (20,40 %) tratadas quirúrgicamente recidivaron, de ellas el 40 % (4/10) pertenecían al grupo de citorreducción óptima inicial y 60 % (6/10) pertenecían al grupo sin citorreducción óptima inicial (citorreducción sub-óptima o quimioterapia neoadyuvante). Los resultados de recidiva desde cada uno de los grupos fueron los siguientes: 22,22 % (4/18) en las pacientes con citorreducción óptima inicial, 14,28 % (3/21) en las pacientes con citorreducción sub-óptima inicial, observándose recidiva en 18,18 % (2/11) de las que fueron a citorreducción secundaria, y un 30 % (3/10) recidivaron las pacientes con quimioterapia neoadyuvante.
DISCUSIÓN
Se encontró durante el período estudiado 54 canceres ováricos avanzados en el IAHULA, evidenciando así que de cada 5 pacientes diagnosticadas como cáncer ovárico, 3 de ellas se encuentran en un estadio III o IV, siendo este hallazgo similar al reportado por otros autores (21,22).
El grupo etario con pico de incidencia de cáncer ovárico avanzado, fue de 50 a 59 años y con media de 50 años, contrastando estos datos con casi todos los reportes revisados de países desarrollados, que describen una media entre 59- 63 años y un pico después de 70 años (23,24); en sólo un estudio europeo, se halló reporte de edad media menor 59 años, siendo de 55 años (22). Sin embargo, la edad media reportada en series de Latinoamérica: en México reportan promedio 50,39 años en canceres ováricos avanzados (25) y en Venezuela cáncer epitelial 49,6 años (26). Esta discrepancia podría deberse, a las diferencias en cuanto a las características del ciclo reproductivo de las mujeres venezolanas (o latinas), con respecto a las de países desarrollados y a que la expectativa de vida en el mundo desarrollado, es mayor que la nuestra.
Edad media 51,18 años de los cánceres de origen epitelial tienen un comportamiento similar a la muestra general, debido a que los epiteliales son la mayoría de los casos reportados. La media 28,20 años de edad en origen germinal, fue similar a la ya descrita (27,28).
A pesar de que 50 % de las pacientes se encontraban en peso normal, se halló también que un 34,8 %, se encontraban en sobrepeso y durante la revisión bibliográfica se describió, relación entre el sobrepeso y una sobrevida más corta, que aquellas que se encontraban en su peso ideal (29). Cirugía de intervalo se ha mostrado como no inferior frente a citorreducción primaria en IMC ≥35 referente a sobrevida libre de progresión (SLG) y supervivencia global (SG) (13); no encontrándose en esta oportunidad diferencias entre IMC y tipo de cirugía, ni residuo tumoral posquirúrgico.
Un 9,26 % (5/54) de pacientes no se encontraron datos de cirugía, ni biopsia, sino que en base a algunos parámetros antes mencionados, fueron diagnosticadas y tratadas como cáncer ovárico a base de quimioterapia; se han descrito en base a criterios de irresecabilidad por clínica y sobre todo por imaginología (TAC), muy seleccionadamente se puede abandonar la cirugía inicial y derivar las pacientes a quimioterapia neoadyuvante (18,30,31).
Se demostró un predominio de los estadios III (81,48 %), siendo el IIIc el más frecuente (59,25 %), correspondiendo a lo reportado en la literatura (8).
El riesgo quirúrgico ASA, no se asoció al fracaso de la citorreducción óptima, ni se relacionó con cánceres avanzados de ovario. Sólo 9,3 % (4 casos) de complicaciones peri-operatorias, 75 % de ellas fueron posquirúrgicas y 25 % trans-operatorias. Todas estas complicaciones se presentaron en pacientes en que la citorreducción primaria óptima no fue posible y el 75 % de ellas, (las 3 posoperatorias) ocurrieron en las del grupo ASA 2. Nuestros resultados no reportaron mayor riesgo de complicaciones peri-operatorias y problemas de lograr citorreducción primaria óptima, como a diferencia de lo ya descrito con ASA 3 y 4 (32,33). Una publicación (SCORPION trial) muestra que quimioterapia neoadyuvante/cirugía de intervalo es significativamente mejor a citorreducción primaria en términos de complicaciones peri-operatorias, pero sin diferencias en cuanto a calidad de vida (34).
El tratamiento estándar y recomendado, para el cáncer de ovario avanzado, es la citorreducción radical o máximo esfuerzo quirúrgico de entrada, seguido por combinación de quimioterápicos, como por ejemplo, los derivados del platino y los taxanos (35,36). Sin embargo, a partir de la década de los ´90, la quimioterapia neoadyuvante como opción en pacientes, en que el estado de salud no les permita cirugía inicial, o en aquellas que se predice que la cirugía será sub-óptima, se ha transformado en una posibilidad con muchas ventajas (8,13,37,38,39,4041). En ésta oportunidad se obtuvo una experiencia con neoadyuvancia de 10 casos, lo que representó el 18,51 % de las pacientes.
Las combinaciones de fármacos antineoplásicos que hallamos, coinciden con las descritas en los estudios publicados para la fecha de los casos tratados en este manuscrito, que aún siguen teniendo vigencia nacional e internacionalmente (1,8,41,42,43).
La buena respuesta a la quimioterapia, aumenta la sobrevida hasta en un 50 % (44,45), en ésta oportunidad la gran mayoría (86,36 %) presentó una respuesta adecuada, similar a otro estudio venezolano (8).
Estudios han reportado, un buen porcentaje de citorreducción óptima, después de culminado el tratamiento por cirugía de intervalo (67,9 % - 81,8 %) (8,10,17); en esta investigación, la optimización quirúrgica se logró en el 70 %, los resultados están dentro del rango de lo descrito, pero hay que resaltar que, en los estudios citados la gran mayoría de los cánceres eran poco diferenciados y en este estudio los moderadamente diferenciados estuvieron a la par de aquellos que se diferenciaron pobremente. Siendo la cirugía del intervalo, una opción buena en aquellas pacientes a las que no se les puede hacer citorreducción óptima primaria; sin embargo, aún no hay consenso en cuanto a cuales pacientes y cuando debe llevarse a citorreducción primaria vs., quimioterapia neoadyuvante con cirugía de intervalo (46,47).
Aunque la quimioterapia neoadyuvante con cirugía de intervalo posterior sigue siendo una opción inicial de terapia para cáncer ovárico IIIc y IV, hay reportes que para año 2010 parece no ser suficiente la evidencia para convencer a los ginecólogos-oncólogos de los grandes centros de tratamiento en cáncer ovárico estadios avanzado, para que sustituyan la citorreducción primaria + quimioterapia por quimioterapia neoadyuvante + cirugía de intervalo + quimioterapia pos-cirugía (48), estudio en el cual el 94,6 % eran especialistas estadounidenses; por otro lado muy recientemente se ha publicado un estudio de EE.UU (49), donde se incrementó casi triplicándose pacientes que recibieron quimioterapia neoadyuvante-cirugía de intervalo entre 2004 (8,6 % de las pacientes) y 2013 (22,6 % de las pacientes), siendo más notorio la indicación de quimioterapia neoadyuvante a partir del año 2007, incluso fecha anterior a la publicación de Vergote y col. (41) que demuestran no inferioridad en cuanto a supervivencia de quimioterapia neoadyuvante frente a citorreducción primaria.
Sólo una quinta parte de las pacientes, presentaron recidiva, contribuyendo a ella todos los esquemas quirúrgicos descritos, encontrándose números similares entre los 3 grupos, siendo el grupo que inicialmente fue a quimioterapia neoadyuvante el cual mostró discreta mayor recidiva con respecto a los otros grupos. Al contrario de lo descrito en múltiples estudios, de las pacientes que recidivaron en la enfermedad (50), la mayoría eran cánceres histológicamente bien diferenciados.
La serie estudiada muestra resultados interesantes referentes a citorreducción secundaria, con 63,63 % de residuo tumoral óptimo y solo un 18,18 % de recidiva. Aunque Rose y col., en 2004 (16) reportan que la citorreducción secundaria anexada a un esquema de quimioterapia posoperatoria a citorreducción primaria sub-óptima con máximo esfuerzo no mejoran SLG, ni SG; en 2016 el mismo autor (51) concluye que a pesar que la citorreducción secundaria no cambia SLG ni SG, esta vez demuestra que la respuesta patológica a esta cirugía secundaria se asocia como predictor de mejoría de SLG y SG, sin asociarse a su vez con otros factores pronósticos conocidos, lo que descarta la presencia de sesgo por factor de confusión, y mostrándose tener resultados evidentes mejores en respuesta patológica completa con respecto a respuesta patológica parcial y residuo tumoral grueso.
Muy recientemente investigadores canadienses (52) en un estudio retrospectivo incluyendo 263 pacientes en 13 años, reportan mejoría de los resultados de supervivencia con quimioterapia neoadyuvante en pacientes que habrían tenido enfermedad residual después de citorreducción primaria, y que logren una citorreducción completa en el momento de la citorreducción de intervalo y sugieren que esta opción de tratamiento se puede utilizar en pacientes seleccionados que no son candidatos para citorreducción completa en la cirugía primaria. Este estudio aunque casi triplica el tiempo estudiado y casi quintuplica el número de pacientes, sin embargo, le da vigencia a la experiencia acá reportada.
Una de las ideas iniciales de ésta investigación, fue calcular la sobrevida promedio de las pacientes tratadas por cáncer ovárico avanzado, sin embargo, no se pudo llevar a cabo, porque el archivo de historias médicas que contiene los datos de pacientes fallecidas no está disponible para su revisión, según informó el personal de historias médicas.
Podemos concluir:
El número total de pacientes con cáncer de ovario avanzado, que fueron tratadas en el IAHULA, entre enero 2002 a diciembre 2006, fue 54 casos. Seis (6) de cada 10 mujeres que son diagnosticadas como cáncer de ovario en el IAHULA, presentan ya un estadio avanzado. El grupo de edad en el cual se ubicó el pico de incidencia de cáncer ovárico avanzado en general, fue de 50 a 59 años. Los epiteliales siguieron éste mismo comportamiento, sin embargo, los de origen germinal se presentaron en edades precoces (tercera década de vida). Antígeno carbohidratado 125 tuvo promedio en general de 315,61, condición que estuvo muy cercana en los cánceres epiteliales y sobretodo en los serosos. Mientras que la alfafetoproteína estuvo muy elevada en los cánceres germinales. El origen epitelial, representó 9 de cada 10 casos, y a su vez de ellos el seroso fue el más frecuente. La gran mayoría de pacientes recibió tratamiento quirúrgico (9 de cada 10) y se logró realizar citorreducción óptima inicial en el 46,16 % de los casos y sub-óptima en 53,84 %. El peso y el riesgo quirúrgico estimado por escala ASA no determinaron el tipo de tratamiento quirúrgico empleado. El estadio FIGO más encontrado fue el IIIc y el grado de diferenciación fue G2. Cuando inicialmente fue sub-óptimo o irresecable, después del tratamiento adyuvante se logró citorreducción optima en 2/3 partes de las pacientes. No se encontró un importante número de complicaciones peri-operatorias en estas pacientes. La cirugía de intervalo y citorreducción secundaria resultó ser una gran opción de tratamiento para las pacientes en donde se dificulte la citorreducción óptima inicial. Más del 90 % de las pacientes recibió tratamiento adyuvante, y casi la totalidad de ellas recibió quimioterapia. La mayoría de ellas recibió la adyuvancia después de un primer tratamiento quirúrgico; la combinación de carboplatino y ciclofosfamida fue la más comúnmente empleada y 8 de cada 10 pacientes evidenciaron buena respuesta, notándose además que esta última fue independiente del tipo de cirugía empleada.
RECOMENDACIONES
· Organizar el archivo de historias médicas, que concierne a las pacientes fallecidas, porque los datos que pudiera obtenerse del mismo, nos daría información por ejemplo acerca de la supervivencia de las pacientes en algunas patologías como la aquí investigada.
· Tratar de indagar y prestar oportuna atención a los síntomas “inespecíficos”, referidos por las pacientes con riesgo epidemiológico para cáncer de ovario, a fin de tratar de lograr precocidad en el diagnóstico.
· Intentar darle el gran beneficio de la citorreducción a la paciente con estadios avanzados de cáncer de ovario.
· Considerar siempre que no se pueda una citorreducción óptima inicial, la posibilidad de tratamiento quirúrgico de intervalo o citorreducción secundaria.
Referencias
1. Sánchez LJ, Di Giampietro L, Medina F, Rodríguez J, Rezic M, Nass I, et al. Primer Consenso Nacional de Cáncer epitelial de ovario diagnóstico y tratamiento. Rev Venez Oncol. 2014;26(3):235-92.
2. Leary AF, Quinn M, Fujiwara K, Coleman RL, Kohn E, Sugiyama T, et al. 5th ovarian cancer Consensus conference of the gynecologic cancer InterGroup (GCIG): Clinical trial design for rare ovarian tumors. Ann Oncol. 2017 1;28(4):718-772.
3. McGee J, Bookman M, Harter P, Marth C, McNeish I, Moore KN, et al. 5th Ovarian Cancer Consensus Conference: Individualized therapy and patient factors. Ann Oncol. 2017; 1;28(4):702-710.
4. Levy G, Purcell K. Premalignant and malignant disorders of the ovaries and oviducts. En: DeCherney AH, Nathan L, Laufer N, Roman AS, editores. Current diagnosis & treatment obstetric & gynecologic. 11a edición. New York: McGraw-Hill; 2013. p. 848-858.
5. Anuario de mortalidad 2005. Dirección General de Epidemiología y Dirección de Información Social y Estadística del Ministerio de Salud. Gobierno Bolivariano de Venezuela. Disponible en: URL:www.bvs.gob.ve/anuario/Anuario2005.pdf
6. Jemal A, Murria T, Ward E, Samuels A, Tiwari RC, Ghafoor A, et al. Cancer Statistics, 2005. CA Cancer J Clin. 2005;55:10-30.
7. Botella J. Nuestra experiencia sobre el cáncer de ovario. ACTA GINECOLOGICA. 2001;58(6):143-50.
8. Zenzola V, Sánchez J, Hidalgo F, Soto G, Castillo J, Andrade A, et al. Cirugía citorreductora posterior a quimioterapia neoadyuvante: En cáncer epitelial de ovario avanzado. Rev Venez Oncol. 2005;17(3):122-128.
9. Escudero M. Nuevos enfoques en el tratamiento del cáncer de ovario en mujeres jóvenes. ACTA GINECOLOGICA. 2000;52(1):21-32.
10. Palacios L, Suárez C, Mijares A, Vera R, Delgado B. Cirugía de intervalo citorreducción óptima en cáncer de ovario estadio III. Rev Venez Oncol. 2009;21(2):85-91.
11. Eisenhauer EL, Abu-Rustum NR, Sonoda Y, Levine DA, Poynor EA, Aghajanian C, et al. The addition of extensive upper abdominal surgery to achieve optimal cytoreduction improves survival in patients with stages IIIc-IV epithelial ovarian cancer. Gynecol Oncol. 2006;103:1083-1090.
12. Vergote I, van Gorp T, Amant F, Neven P, Berteloot P. Neoadjuvant chemotherapy for ovarian cancer. Oncology. 2005;19:1615-1622.
13. Worley MJ Jr, Guseh SH, Rauh-Hain A, Esselen KM, Muto MG, Feltmate CM, et al. What is the optimal treatment for obese patients with advanced ovarian carcinoma? Am J Obstet Gynecol. 2014;211(3):231.e1-9.
14. Hoskins WJ, McGuire WP, Brady MF, Homesley HD, Creasman WT, Berman M, et al. The effect of diameter of largest residual disease on survival after primary cytoreductive surgery in patients with suboptimal residual epithelial ovarian carcinoma. Am J Obstet Gynecol. 1994;170:974-979.
15. van der Burg M, Vergote I, Gynecological Cancer Group of the EORTC. The role of interval debulking surgery in ovarian cancer. Curr Oncol Rep. 2003;5(6):473-481.
16. Rose PG, Nerenstone S, Brady MF, Clarke-Pearson D, Olt G, Rubin SC, et al. Secondary surgical cytoreduction for advanced ovarian carcinoma. N Engl J Med. 2004;351(24):2489-2497.
17. Serrano A, Tarjuelo A, Ortíz L, Álvarez J, López N, Salazar P, et al. Cirugía de intervalo como alternativa en el manejo del cáncer de ovario en estadios avanzados. ACTA GINECOLOGICA. 2005;62(4):95-96.
18. Nelson BE, Rosenfield AT, Schwartz PE. Preoperative abdominopelvic computer tomographic prediction of optimal cytoreduction in epithelial ovarian carcinoma. J Clin Oncol. 1993;11:166-172.
19. Swenwrton K, Jeffrey J, Stuart G, Roy M, Krepart G, Carmichael J, et al. Cisplatin-cyclophosphamide versus carboplatin-cyclophosphamide in advanced ovarian cancer: A randomized phase III study of the National Cancer Institute of Canada Clinical Trial Group. J Clin Oncol. 1992;10:718-726.
20. Sobrero S, Pagana E, Piovano E, Bono L, Ceccarelli M, Ferrero A, et al. Is ovarian cancer being managed according to clinical guidelines? Evidence from a population-based clinical audit. Int J Gynecol Cancer. 2016;26(9):1615-1623.
21. Jacobs IJ, Stakes SJ, Mc Donald N, Menon U, Rosenthal AN, Davies AP, et al. Screening for ovarian cancer: A pilot randomized controlled trial. Lancet 1999;353(9160):1207-1210.
22. Abenhaim HA, Titus-Ernstoff L, Cramer DW. Ovarian cancer risk in relation to medical visits, pelvis exminations and type of health care provider. CMAJ. 2007;176(7):941-947.
23. Cancer of the ovary. Cancer stat fact sheets. National Cancer Institute SEER. Disponible en: URL: https://seer.cancer.gov/statfacts/html/ovary.html 2017.
24. Bruchim I, Altaras M, Fishman A. Age contrasts in clinical characteristics and pattern of care in patients with epithelial ovarian cancer. Gynecol Oncol. 2002;86(3):274-278.
25. Martinez-Said H, Rincon DG, Montes De Oca MM, Ruiz GC, Ponce JL, Lopez-Graniel CM. Predictive factors for irresectability in advanced ovarian cancer. Int J Gynecol Cancer. 2004;14:423-430.
26. Ministerio del Poder Popular para la Salud, Programa de Oncología. Registro Nacional de Cáncer. Venezuela 2013. Disponible en: URL: http://www.mpps.gob.ve.
27. Matei DE, Russell AH, Horowitz CJ, Gershenson DM, Silva E. Ovarian germ-cell tumors. En: Hoskins WJ, Young RC, Markman M, Perez CA, Barakat R, Randall M, editores. Principles and Practice of Gynecologic Oncology. 4a edición. Filadelphia: Lippincott Williams & Wilkins; 2005. p. 989-1009.
28. Verdecia C, Portugués A. Tumores germinales malignos de ovario en niñas y adolescentes. Rev Cubana Pediatr. 2006;78(4):1-5.
29. Li AJ, Elmore RG, Pavelka JC, Parlan BY. Hyperandrogenism, mediated by obesity and receptor polymorphisms, promotes aggressive epithelial ovarian cancer biology. Gynecol Oncol. 2007;107(3):420-423.
30. Kuhn W, Rutke S, Spathe K, Schmalfeldt B, Florack G, von Hundelshausen B, et al. Neoadjuvant chemotherapy followed by tumor debulking prolongs survival for patients with poor prognosis in International Federation of Gynecology and Obstetrics Stage IIIC ovarian carcinoma. Cancer. 2001;92:2585-2592.
31. Mazzeo F, Berliere M, Kerger J, Squifflet J, Duck L, D`Hondt V, et al. Neoadjuvant chemotherapy followed by surgery and adjuvant chemotherapy in patients with primarily unresectable, advanced-stage ovarian cancer. Gynecol Oncol. 2003;90:163-169.
32. Aletti GD, Gostout BS, Podratz KC, Cliby WA. Ovarian cancer surgical resectability: Relative impact of disease, patient status, and surgeon. Gynecol Oncol. 2006;100(1):33-37.
33. Kumar A, Janco JM, Mariani A, Bakkum-Gamez JN, Langstraat CL, Weaver AL, et al. Risk-prediction model of severe postoperative complications after primary debulking surgery for advanced ovarian cancer. Gynecol Oncol. 2016;140(1):15-21.
34. Fagotti A, Ferrandina G, Vizzielli G, Fanfani F, Gallotta V , Chiantera V, et al. Phase III randomized clinical trial comparing primary surgery versus neoadjuvant chemotherapy in advanced epithelial ovarian cancer with high tumor load (SCORPION trial): Final analysis of per-operative outcome. Eur J Cancer. 2016;59:22-33.
35. Mano MS, Awada A, Minisini A, Atalay G, Lago LD, Cardoso F, et al. Remaining controversies in the upfront management of advanced ovarian cancer. Int J Gynecol Cancer. 2004;14:707-720.
36. Poveda A. Ovarian cancer: Is the news good enough? Int J Gynecol Cancer. 2005;15(3):298-306.
37. Giannopoulos T, Butler-Manuel S, Taylor A, Ngeh N, Thomas H. Clinical outcomes of neoadjuvant chemotherapy and primary debulking surgery in advanced ovarian carcinoma. Eur J Gynaecol Oncol. 2006;27:25-28.
38. Lee SJ, Kim BG, Lee JW, Park CS, Lee JH, Bae DS. Preliminary results of neoadjuvant chemotherapy with paclitaxel and cisplatin in patients with advanced epithelial ovarian cancer who are inadequate for optimum primary surgery. J Obstet Gynaecol Res. 2006;32:99-106.
39. Greimel E, Kristensen GB, van der Burg ME, Coronado P, Rustin G, del Rio AS, et al Quality of life of advanced ovarian cancer patients in the randomized phase III study comparing primary debulking surgery versus neo-adjuvant chemotherapy. Gynecol Oncol. 2013;131(2):437-444.
40. Zeng LJ, Xiang CL, Gong YZ, Kuang Y, Lu FF, Yi SY, et al. Neoadjuvant chemotherapy for patients with advanced epithelial ovarian cancer: A Meta-Analysis. Sci Rep. 2016;6:35914.
41. Vergote I, Tropé CG, Amant F, Kristensen G, Ehlen T, Johnson N, et al. Neoadjuvant chemotherapy or primary surgery in stage IIIC or IV ovarian cancer. N Engl J Med. 2010;363(10):943-953.
42. van der Burg ME, van Lent M, Buyse M, Kobierska A, Colombo N, Favalli G, et al. The effect of debulking surgery after induction chemotherapy on the prognosis in advanced epithelial ovarian cancer. Gynecological Cancer Cooperative Group of the European Organization for Research and Treatment of Cancer. N Engl J Med. 1995;332(10):629-634.
43. Bookman MA. Optimal primary therapy of ovarian cancer Ann Oncol. 2016;27(1):i58-i62.
44. McGuire WP, Ozols RF. Chemotherapy of advanced ovarian cancer. Semin Oncol. 1998;25(3):340-348.
45. Gadducci A, Cosio S, Zola P, Landoni f, Maginos T, Sartori E. Surveillance procedures for patients treated for epithelial ovarian cancer: A review of the literature. Int J Gynecol Cancer. 2007;17:21-31.
46. Trope´ CG, Elstrand MB, Sandstad B, Davidson B, Oksefjell H. Neoadjuvant chemotherapy, interval debulking surgery or primary surgery in ovarian carcinoma FIGO stage IV? Eur J Cancer. 2012;48:2146-2154.
47. Hall TR, Dizon DS. Neoadjuvant chemotherapy for advanced epithelial ovarian cancer. Clin Adv Hematol Oncol. 2016;14(4):262-268.
48. Dewdney SB, Rimel BJ, Reinhart AJ, Kizer NT, Brooks RA, Massad LS, et al. The role of neoadjuvant chemotherapy in the management of patients with advanced stage ovarian cancer: Survey results from members of the Society of Gynecologic Oncologists. Gynecol Oncol. 2010;119:18-21
49. Melamed A, Hinchcliff EM, Clemmer JT, Bregar AJ, Uppal S, Bostock I, et al. Trends in the use of neoadjuvant chemotherapy for advanced ovarian cancer in the United States. Gynecol Oncol. 2016;143(2):236-240.
50. Rahaman J, Dottino P, Jennings TS, Holland J, Cohen CJ. The second-look operation improves survival in sub-optimally debulked stage III ovarian cancer patients. Int J Gynecol Cancer.2005;15:19-25.
51. Rose PG, Java JJ, Morgan MA, Alvarez-Secord A, Kesterson JP, Stehman FB, et al. Disease extent at secondary cytoreductive surgery is predictive of progression-free and overall survival in advanced stage ovarian cancer: An NRG Oncology/Gynecologic Oncology Group study. Gynecol Oncol. 2016;143(3):511-515.
52. Kessous R, Laskov I, Abitbol J, Bitharas J, Yasmeen A, Salvador S, et al. Clinical outcome of neoadjuvant chemotherapy for advanced ovarian cancer. Gynecol Oncol. 2017,144(3):474-479.
Notas de autor
belcarzamra@gmail.com