PROPUESTA DE PROTOCOLO DIAGNÓSTICO, ESTADIFICADOR Y QUIRÚRGICO PARA EL CÁNCER DE ENDOMETRIO
PROPUESTA DE PROTOCOLO DIAGNÓSTICO, ESTADIFICADOR Y QUIRÚRGICO PARA EL CÁNCER DE ENDOMETRIO
Revista Venezolana de Oncología, vol. 31, núm. 1, pp. 24-33, 2019
Sociedad Venezolana de Oncología

Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial-CompartirIgual 4.0 Internacional.
Recepción: 18 Septiembre 2018
Revisado: 15 Octubre 2018
Aprobación: 05 Noviembre 2018
Resumen: OBJETIVO: El carcinoma de endometrio es la neoplasia más frecuente del tracto genital de la mujer en el mundo occidental es una patología que va en ascenso en los países en vías de desarrollo. En general, el pronóstico de carcinoma endometrial es bueno, con una supervivencia global de alrededor del 80 %. Se pueden definir tres grupos de acuerdo al riesgo de recurrencia, en alto, medio y bajo. MÉTODO: Se realiza revisión bibliográfica y casuística para proponer protocolo de manejo quirúrgico en pacientes con cáncer de endometrio. RESULTADOS: Se definen tres etapas durante el protocolo: clínica, patológica y quirúrgica. Se realizan recomendaciones basados en la vía de abordaje, tipo de histerectomía, lavado peritoneal, linfadenectomía, omentectomía, y cito-reducción. Se plantean situaciones especiales y la importancia del ganglio centinela. CONCLUSIONES: La realización de protocolos quirúrgicos para el manejo de carcinoma endometrial permite la unificación de criterios, mejora la evaluación de respuesta terapéutica y facilita revisiones y mejoras a futuro.
Palabras clave: Adenocarcinoma, endometrio, protocolo, quirúrgico, linfadenectomía.
Abstract: OBJECTIVE: The endometrial carcinoma is the most common neoplasia in the genital tract of women in the western world and is a condition that is increasing in the developing countries. In general, the prognosis of endometrial carcinoma is good, with an overall survival of about 80 %. METHOD: It can define three groups according to the risk of the recurrence in high, medium and low. The literature review and case mix is performed to propose the surgical management protocol in patients with endometrial cancer. RESULTS: Three stage the clinical, the pathological and the surgical defined for the protocol. The recommendations based on the approach, type of the hysterectomy, the peritoneal washing, the lymphadenectomy, the omentectomy, and the debulking are made. The special situations and the importance of sentinel node arise. CONCLUSIONS: Performing the surgical protocol for the management of endometrial carcinoma allows the unification of criteria, the improved therapeutic response assessment and facilitates future revisions and improvements.
Keywords: Adenocarcinoma, endometrial, surgical, protocol, lymphadenectomy.
INTRODUCCIÓN
El carcinoma de endometrio es la neoplasia más frecuente del tracto genital de la mujer en el mundo occidental y es una patología que va en ascenso en los países en vías de desarrollo. En general, el pronóstico de carcinoma endometrial es bueno, con una supervivencia global de alrededor del 80 % (1,2,3).
Signos de mal pronóstico incluyen la vejez, la enfermedad avanzada, tumor de alto grado, y las histologías no endometroides, como el carcinoma seroso papilar y el de células claras. Pero sigue siendo el estadio de la enfermedad, al momento del diagnóstico, el parámetro pronóstico más importante. Por lo tanto, la estadificación proporciona una herramienta importante para el pronóstico, comparación de resultados, y facilita recomendaciones para las terapias adyuvantes.
La Federación Internacional de Ginecología y Obstetricia (FIGO) desarrolló su sistema de clasificación y estadificación del carcinoma de endometrio y otros cánceres genitales femeninos en 1958. La puesta en escena de carcinoma de endometrio se modificó a partir de 1988 con la aparición de la estadificación clínica quirúrgica patológica. Una versión revisada fue introducida en 2009, con la finalidad de mejorar aún más el rendimiento pronóstico de la estadificación quirúrgica.
En 1966 la UICC (Unión Internacional Contra el Cáncer), y en 1976 la AJCC (Comisión Americana Contra el Cáncer) establecieron su propio sistema de estadificación. Desde entonces la FIGO, la UICC y la AJCC, han intentado coordinar sus esfuerzos para adoptar un único sistema de estadificación.
A partir de la estadificación quirúrgica, el Gynecologic Oncology Group (GOG) agrupo a los tumores endometroides según el riesgo de progresión:
· Bajo riesgo: estadios IA y IB (G1 - G2)
· Riesgo intermedio: IA – IB G3 y II..
· Alto riesgo: corresponde al resto de los estadios.
El INC coordina el Programa Nacional de Cáncer de EE.UU. y conduce y apoya la difusión de la investigación, prevención, diagnóstico y tratamiento del cáncer, y dentro de ellos incluye al cáncer de endometrio. Anualmente realiza actualizaciones de protocolos terapéuticos sobre esta y otras neoplasias.
La finalidad de esta revisión es proponer un protocolo terapéutico estandarizado sobre el tratamiento del cáncer de endometrio, basado en la experiencia recabada en la literatura y en nuestro centro hospitalario.
Dicha estadística es de tipo retrospectivo y fue recabada de 350 pacientes ingresados al servicio de ginecología oncológica del IOMPC, y en quienes cumplimos todos los criterios diagnósticos, estadificadores y quirúrgicos, descritos en este trabajo y cuyos datos fueron registrados a traves de ficha epidemiológica de manera retrospectiva.
La finalidad de este protocolo es unificar criterios para un mejor manejo del paciente, evaluaciones pronosticas, efectividad terapéutica e investigaciones futuras.
No es la intensión de este documento analizar o comparar los protocolos existentes ni calificar los diferentes sistemas de estadificación.
SISTEMA DE ESTADIFICACIÓN
La finalidad de cualquier sistema de estadificación es permitir la comparación de pacientes entre diferentes centros y poder así clasificarlos en diferentes grupos pronósticos.
La clasificación de la FIGO (Federación Internacional de Ginecología y Obstetricia) para el cáncer de endometrio (CE) se ha modificado recientemente y aporta un sistema de fácil reproducción, y una adecuada aproximación pronostica en cada uno de sus estadios. Al ser una clasificación clínica- quirúrgica- patológica implica la estrecha relación de tres fases durante el proceso diagnóstico y terapéutico.
En nuestro servicio sugerimos la utilizacion de dicho sistema, el cual resulta adecuado y repoducible a todos nuestros pacientes
ETAPA CLÍNICA- PATOLÓGICA
Dicha etapa tiene como finalidad definir la presencia del CE, a través de signos y síntomas clásicamente definidos y la confirmación histológica.
Signos que deben ser tomados en cuenta: la edad (50-60 años), raza, país, antecedentes familiares de adenocarcinomas, fertilidad y paridad. Hipertensión, obesidad y diabetes. Menopausia tardía. Estado de hiperestrogenismo endógeno o exógeno (Criterios Borkman tipo I y II). Tamoxifeno. Patología endometrial previa como las hiperplasias. Presencia de otras neoplasias como el cáncer de mama o endometrio.
Síntomas como metrorragia irregular o posmenopáusica, leucorrea y dolor. Además de estos tres, existirían un grupo heterogéneo derivado del grado de invasión vecina y extensión a distancia, a parte de los síntomas generales finales de todo proceso oncológico (Las 4 A): astenia, anorexia, adelgazamiento y anemia.
Durante esta etapa debe constatarse la presencia anatomopatológica del carcinoma uterino a través de la biopsia endometrial con un nivel de (evidencia 1B) (4). Recomendamos realizarla de forma expedita en el consultorio a través de microlegra rígida o con cánulas flexibles que tienen un diámetro externo de 3 mm y con un sistema de vacío de baja intensidad.
Se puede realizar legrado bajo anestesia de la cavidad endometrial o la histeroscopia con biopsia dirigida.
La histeroscopia nos ha aportado un importante progreso en el diagnóstico temprano del carcinoma de endometrio, nivel de (evidencia 2) (4). En la perimenopausia no es infrecuente encontrar adenocarcinomas focales, muy localizados, que de no visualizarse para dirigir la pinza de biopsia, pudieran pasar desapercibidos, incluso durante un legrado convencional. Otro gran aporte de la histeroscopia es la ayuda en el diagnóstico locorregional y concretamente en la invasión del cérvix.
Solo en aquellos pacientes de alta sospecha clínica y en quienes las biopsias no fueron efectivas, consideramos la histerectomía con biopsia intraoperatoria.
Recomendamos definir en esta etapa la extensión locorregional y la enfermedad a distancia a través del examen físico y métodos paraclínicos con la intensión de establecer los criterios de inoperabilidad.
Debe evaluarse la invasión cervical, vaginal, vulvar y parametrial a través de la inspección palpación minuciosa. El tacto bajo anestesia se considera opción adecuada en pacientes que no toleren el examen
El ultrasonido vaginal con transductor de alta frecuencia es importante tanto para la sospecha diagnóstica ante un endometrio engrosado o heterogéneo, asi como para evidenciar invasión miometrial, señalándose hasta un 80 % 90 % de correlación. Por tal motivo es indicado a todos nuestros pacientes.
La tomografía axial computarizada (TAC) abdominal con contraste visualiza la lesión y el límite con el miometrio. La concordancia diagnóstica oscila alrededor del 85 %. El problema del TAC es su menor especificidad para discriminar en partes blandas pélvicas (5).
El empleo de resonancia magnética (RMN) en pacientes con cáncer de endometrio permite profundizar el diagnóstico y diferenciar entre la ausencia o presencia de invasión miometrial menor o mayor de 50 %. En caso de dudas con las imágenes T2, el protocolo se extiende para incluir secuencias dinámicas sagitales y T1. Al mismo tiempo, la comparación entre T1 y T2 permite, por lo general, discernir la causa de una señal anómala; si se debe a la presencia de fibroadenomas o a una adenomiosis asociada.
Nuestro centro recomienda la indicacion de RMN como estudio ideal para obtener información imaginológica que permita la planificación del tratamiento quirúrgico, en los casos que este contraindicado o no disponible se plantea la realizacion del TAC con contraste endovenoso (5).
Es importante comentar que la imposibilidad de la realizacion de dichos estudios no contraindicala realización del tratamiento quirúrgico si es pertinente
Con respecto al CT-PET y a la RMN-PET representan estudios importantes para el diagnóstico de la enfermedad recurrente. Como métodos de screening e invasión miometrial no superan a los estudios por imágenes convencionales, no así con las adenopatías iliaca-obturatrices y pre-aórticas donde su sensibilidad es superior, no obstante, como la relación con malignidad en las adenopatías esta en relación directa con su tamaño, y ante la necesaria comprobación histológica para definir pronóstico, aun es discutido su real utilidad (6).
Nosotros no recomendamos la realización del CT-PET como estudio rutinario y es considerada como método alternativo para la identificación de recaída asintomática.
El marcador tumoral Ca 125 lo consideramos de utilidad pronostica en las variedades histológicas no endometroides, por su mayor porcentaje de diseminación celomica desde estadios iniciales.

Cuadro 1.
Estudios solicitados en pacientes con CE
CRITERIOS DE IRRESECABILIDAD
Se considera su determinación como resultado final de la evaluación en la etapa clínica- patologica, y son los que definirán la realización de una cirugía con criterio estadificador, radical (control locorregional) y/o citorreductor.
Criterio absolutos
Enfermedad vaginal
Infiltración parametrial
Criterios Relativos
Status performance del paciente
Infiltración vesical
Infiltración recto bajo
Infiltración cervical
Ascitis
Enfermedad en epiplón
Plastrones ganglionares abdominales
Enfermedad hepática
Estos criterios se basan en nuestra experiencia quirúrgica durante la realización de protocolos estadificadores y la disponibilidad de material e instrumental quirúrgico adecuado al momento de la cirugía y de adecuado soporte posoperatorio (11).
ETAPA QUIRÚRGICA PROTOCOLO QUIRÚRGICO
1. Vía de abordaje
La vía de abordaje en endometrio fue de inicio controversial y pragmática. Pero ha representado la puerta de entrada a la cirugía mínimamente invasiva en ginecología oncológica.
La técnica usual preconiza la laparotomía media como el estándar, pero actualmente la cirugía laparoscópica y robótica han sido adoptadas con excelentes resultados desde el punto de vista de seguridad y confiabilidad a razón de poder reproducir de manera correcta los tiempos y reparos quirúrgicos necesarios (7). La viabilidad de la laparoscopia para este propósito ha sido demostrado por el Grupo de Oncología Ginecología (LAP2) a través de un estudio prospectivo, multi-institucional aleatorizado, en más de 2 500 pacientes entre 1996 y 2005 (8).
La decisión de la vía correcta está en manos de la capacitación y experiencia del cirujano.
En nuestro centro recomendamos la laparotomía como método tradicional y la vía laparoscópica por aquellos cirujanos entrenados y con una adecuada curva de aprendizaje (nivel de evidencia Ia) (4). A su vez se debe evitar la morcelación uterina y si el tamaño del útero es demasiado grande para su extirpación vía vaginal, es preferible utilizar la vía abdominal (9).
2. Lavado peritoneal- muestra de líquido peritoneal
En este procedimiento, el cirujano “lava” las cavidades abdominales y pélvicas con solución salina (agua salada) y envía los líquidos al laboratorio para determinar si contienen células cancerosas. A esto también se le llama lavado peritoneal. Actualmente no es utilizado como método estadificador por la FIGO pero recomendamos seguir realizándose y reportar su resultado (9,10,11).
3. Tipo de histerectomía
Todavía se observa el empleo de la clasificación de Piver-Rutledge-Smith publicada en 1974 por algunos centros, pero en 2008 Querleu-Morrow realizaron una revisión de la misma basada en reconocer la extensión de la resección parametrial como el único parámetro para diferenciar los diferentes tipos de histerectomías radicales y que fueron definidas para el cancer de cuello uterino y fueron extrapoladas para el cáncer de cuerpo uterino (2).
En la clasificación de Querleu-Morrow, se utiliza la orientación espacial en la pelvis, de acuerdo a la nomenclatura internacional (medial, lateral, caudal, craneal, dorsal, ventral). Esta orientación espacial de la pelvis se utiliza para indicar la extensión de la resección de los parametrios. Además se incluye en esta clasificación la preservación de nervios.
En el 2011 se realizó un consenso para crear una nueva clasificación, basada en la necesidad de clasificar la resección de parametrios en tres dimensiones, que es un tópico importante que exige una nueva clasificación.
La profundidad de la resección en los parametrios en histerectomías radicales es un problema universal y principalmente no explorados en la mayoría de los manuscritos de histerectomías radicales (11,12,13,14).
En esta nueva clasificación aparecen como autores: Cibulay col., que forman parte de instituciones como Memorial Sloan-Kettering, Instituto Nacional del Tumor en Milán, Escuela de medicina Charite en Alemania, entre otras (15).
En esta nueva clasificación hay 4 tipos y se dividen en A, B, C y D.
El tipo A corresponde a la histerectomía extrafascial, garantizando la remoción del tejido paracervical hasta la cúpula vaginal. El uréter no necesita ser destechado y no hay resección del parametrio. El plexo hipogastrio por lo tanto se conserva.
En el tipo B el plexo hipogástrico se preserva, el uréter se diseca desde el cérvix, y se reseca aproximadamente 1 cm - 1,5 cm del parametrio lateral, 2 cm parametrio dorsal y en sentido longitudinal el límite inferior es el corte vaginal, sin sobrepasar el curso del uréter.
Tipo C consiste en la remoción total del parametrio. Se subdivide en tipo C1 con preservación del nervio hipogástrico inferior y C2 sin preservación del nervio.
El tipo D se diferencia del C2 en la extensión lateral del parametrio, porque se requiere la ligadura y resección de la arteria y vena iliaca interna, con sus ramas, incluyendo la A, glútea, pudenda interna y vasos obturadores.
La histerectomía radical con ooforectomía bilateral es el pilar, en el tratamiento del cáncer de endometrio útero-confinado, recomendamos realizar histerectomía radical tipo A más ooforosalpingectomía bilateral para el control locorregional de adenocarcinoma de endometrio.
En los casos de invasión cervical identificada durante la fase de evaluación clínica y cumpla criterios de resecabilidad (enfermedad menor de 4 cm), se recomienda realizar histerectomía tipo C más ooforosalpingectomía bilateral.
4. Linfadenectomía
La linfadenectomía sigue siendo un punto controversial en el manejo del cáncer de endometrio. La linfadenectomia es el factor pronóstico más importante. El 10 % de los estadios I tienen ganglios positivos y originan el 50 % de las recurrencias.
Según los protocolos de procedimiento del Gynecologic Oncology Group (GOG) las cadenas linfáticas ganglionares que se deben evaluar en el tratamiento del CE incluyen los ganglios para-aórticos o lumbo-aórticos (regiones para-aórtica izquierda, latero-cava derecha e inter- aorto-cava hasta el nivel de las venas renales) y los ganglios pélvicos de arterias iliacas común, iliacas externas e internas y fosa obturatriz (16,17).
En las guías de práctica clínica de la FIGO aconsejan realizar una linfadenectomía pélvica siempre que exista invasión del miometrio (cualquiera que sea) y en el caso de invasión superior al 50 % del miometrio, nódulos sospechosos, ganglios pélvicos positivos o ciertos tipos histológicos, hacer también una linfadenectomía para-aórtica. La linfadenectomía para-aórtica nos servirá, no solamente para estadificar, sino además para seleccionar a las pacientes que se beneficiarán de un tratamiento complementario con RT extendida a cadenas para aórticas.
A la linfadenectomía le falta valor terapéutico en estadios iniciales (evidencia 1A) (11). Una revisión sistemática y meta-análisis de los ECA por Cochrane 2015, informó que no hubo diferencia significativa general entre la linfadenectomía y recaída en los pacientes que tenían linfadenectomía frente a aquellos que no lo hicieron en casos de CE en estadio precoz y variedad histológica favorable. Además, las mujeres sometidas a linfadenectomía experimentaron eventos adversos más graves que los que no se someten a una linfadenectomía (12).
Se han descrito múltiples variedades técnicas. Desde la linfadenectomía completa tipo Wherteim, dejando los vasos totalmente disecados, a la selectiva, que puede ser, mínima (Novak), resecando o muestreando la mitad superior de las iliacas comunes y paraaórticos inframesentéricos.
La utilidad de la linfadenectomía como método pronóstico-terapéutico vs., la radioterapia adyuvante persiste abierta.
La presencia de invasión miometrial presente y mayor del 50 % puede ser identificada durante la fase clínica a través de los estudios por imagen tales como ultrasonido intravaginal con sonda de alta densidad, TAC o RMN, siendo importante para la toma de decisión en la planificación prequirúrgico.
En pacientes con sospecha de enfermedad útero confinado sugerimos realizar evaluación anatomopatológica intraoperatoria de la pieza uterina. En los pacientes de bajo riesgo, tipo histológico endometroide y ausencia de enfermedad extrauterina recomendamos no realizar linfadenectomía pélvica porque el beneficio la información pronostica y utilidad terapéutica es menor que la morbilidad del procedimiento en sí mismo (11).
En el resto de situaciones se debe realizar la linfadenectomía iliaco obturatriz bilateral de manera reglada y estandarizada para fines terapéuticos y estadificadores.
La linfadenectomía pre aórtica debe ser realizada de manera rutinaria en pacientes con enfermedad intra abdominal, alto riesgo, tipos histológicos no endometroides o desfavorables.
Aquellos pacientes de riesgo intermedio o alto que durante la evaluación quirúrgica estadificadora, se evidencia adenopatías mayores de 1 cm, sospechosas de enfermedad metastásica, se recomienda enviar a anatomía patológica para biopsia intraoperatoria y en caso de ser positiva proceder a la linfadenectomía pre aórtica.
5. Omentectomía
Recomendamos realizarla como parte del proceso estadificador, y toma vital importancia en los tipos histológicos desfavorables como el seroso papilar y el carcinoma de células claras donde la diseminación celómica es de mayor frecuencia (11).
6. Muestreo de lesiones sospechosas - Cito reducción
Deben ser resecadas y biopsiadas todas las lesiones sospechosas de enfermedad extra uterina a nivel pélvico y abdominal. Si el cáncer se ha propagado a través del abdomen, el cirujano puede intentar la extirpación del tumor tanto como sea posible.
Este procedimiento se llama cito reducción quirúrgica. La cito reducción quirúrgica del cáncer de endometrio puede ayudar a otros tratamientos, como la radiación o la quimioterapia, a funcionar mejor.
La cito reducción es útil para otros tipos de cáncer, y también puede ayudar con el tratamiento de algunos tipos de cáncer de endometrio.
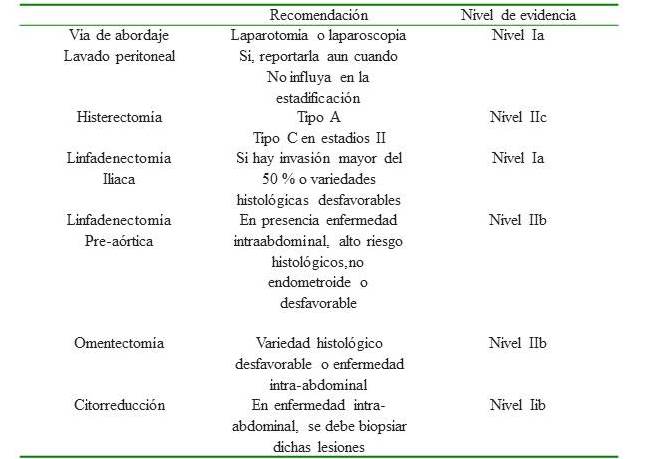
Cuadro 2.
Cirugía estadiadora de endometrio.
7. Situaciones especiales
a. Protocolos incompletamente realizados
Se debe completar la cirugía clasificadora en aquellos pacientes con criterios de operabilidad, en quienes, por fallas diagnósticas o diferimiento intra-operatorio , no se le pudo realizar el protocolo estadificador.
Aquellos pacientes quienes durante acto operatorio se definan criterios de inoperabilidad, se deberán estadificar de manera clínica e indicárseles radioterapia pos operatoria. Un punto de análisis es en los pacientes de variedades histológicas desfavorables como el seroso papilar, el de células claras, carcinosarcoma, los cuales se benefician con quimioterapia de inducción para realización de cito-reducción secundaria.
b. Preservación de fertilidad
En pacientes con deseo de fertilidad, en estadios con enfermedad útero confinada, y que imaginológicamente sugieran invasión menor del 50 %, con histología endometroide G1 se pueden plantear protocolos conservadores como la conservación uterina y tratamiento con progestágenos, antiestrógenos e inhibidores por tiempo determinado y posterior a la fertilidad completar procedimiento quirúrgico. Estos métodos están aún en revisión y deben ser evaluadas de manera estricta (1).
Otros procedimientos descritos son la conservación de ovarios, conservación de gametos.
Recomendamos la asesoria y trabajo en equipo con gineco-obstetras especialistas en técnicas de fertilidad
c. Ganglio centinela
El mapeo de ganglio linfático centinela puede ser utilizado para el cáncer de endometrio en etapas iniciales, si el médico sabe que no hay propagación obvia del cáncer a los ganglios linfáticos de la pelvis, basándose en los estudios por imágenes.
Ballester y col., presentan una tasa de detección del 80 % y concluyen que el ganglio centinela podría ser un paso intermedio entre la linfadenectomía sistemática y la no disección ganglionar en pacientes con CE de riesgo bajo- intermedio. Este estudio también sugirió́ que la biopsia del ganglio centinela puede proporcionar un plazo importante para adaptar la terapia adyuvante (13).
En este procedimiento, se inyecta un tinte azul patente 0,5 cm periorificial cervical. Los ganglios linfáticos que se tornan azules (a causa del tinte) se extirpan durante la cirugía. Estos ganglios linfáticos se examinan detenidamente para ver si contienen células neoplásicas (estadificación- ultraestadificación) (15).
Su positividad definirá la necesidad o no de realizar la linfadenectomía iliaco obturatriz y pre aórtica. How y col., demostraron que la biopsia del ganglio centinela intra-operatoria es factible y obtiene tasas de detección adecuadas. El estudio mostró sensibilidad (S) del 89 %, una especificidad (E) del 100 % y un valor predictivo positivo (VPP) del 100 %. La detección del GC fue independiente del tipo histológico o grado de CE (15).
En nuestro centro se encuentra en la fase de recolección y validación de datos así como definiendo curva de aprendizaje por lo que su papel dentro del protocolo es a título de investigación prospectiva.
C. Tratamiento del cáncer recurrente
El tratamiento de las recidivas de CE tipo I está condicionado por tres factores: la localización de la recidiva (local o a distancia), del tratamiento radioterápico previo y el estado físico de la paciente.
Para la mayoría de las pacientes en estadios iniciales con una recurrencia en la pelvis se recomienda radioterapia radical en lugar de cirugía, especialmente si no han sido previamente irradiadas (evidencia 2C).
Las recurrencias vaginales aisladas en un campo previamente irradiado pueden ser resecado completamente a través de rescate quirúrgico (evidencia 2C), siempre y cuando no existe evidencia de participación retroperitoneal o extensión de la enfermedad a la pared de la pelvis (18).
En la mayoría de las series, la cirugía generalmente fue seguida por el tratamiento de quimioterapia o radiación si no han recibido previamente (19).
En caso de recidivas de CE tipo II, se debe individualizar cada caso, similar al protocolo terapéutico aplicado a las recidivas del cáncer epitelial de ovario (20,21,22,23).
Referencias
1. Oncoguía SEGO: Cáncer de Endometrio 2010. Guías de práctica clínica en cáncer ginecológico y mamario. Publicaciones SEGO, octubre 2010. Disponible en: URL: http://svgo.es/sites/default/files/EndometrioOncoguia2010.pdf
2. Cáncer endometrial. En: Cunningham GW, editor. 21a edición.. México:Mc Graw-Hill;2009. p. 687-702.
3. Suri V, Arora A. Management of endometrial cancer: A review. Rev Recent Clinl Trials. 2015;10:309-316.
4. Guía clínica del diagnóstico y tratamiento del carcinoma de endometrio. Oncosur 2012: grupo de trabajo oncológico de centros hospitalarios del sur de Madrid. Disponible en: URL: https://docplayer.es/19888841-Guia-clinica-de-diagnostico-y-tratamiento-del-endometrio-endometrio-carcinoma-de.html
5. Hahn HS, Song HS, Lee IH, Kim TJ, Lee KH, Shim JU, et al. Magnetic resonance imaging and intraoperative frozen sectioning for the evaluation of risk factors associated with lymph node metastasis in endometrial cancer. Int J Gynecol Cancer. 2013;23:1411-1416.
6. Cohn D, Goff B, Falk S. Endometrial carcinoma: Pretreatment evaluation, staging, and surgical treatment. Disponible en: URL: https://www.uptodate.com/contents/endometrial-carcinoma-staging-and-surgical-treatment
7. Galaal K, Bryant A, Fisher AD, Al-Khaduri M, Kew F, Lopes AD. Laparoscopy versus laparotomy for the management of early stage endometrial cancer. Cochrane Database Syst Rev. 2012;12(9):CD006655.
8. Walker J, Piedmonte M, Spirtos N, Eisenkop SM, Schlaerth JB, Mannel RS, et al. Laparoscopy compared with laparotomy for comprehensive surgical staging of uterine cancer: Gynecologic Oncology Group Study LAP2. J Clin Oncol. 2009;27:5331-5336.
9. Zapardiel I, Moreno E, Piñera A, De Santiago J. Novel technique for the complete staging of endometrial cancer by single-port laparoscopy. Gynecol Oncol. 2016;140(2):369-371.
10. Boggess JF, Gehrig PA, Cantrell L, Shafer A, Ridgway M, Skinner EN, et al. A comparative study of 3 surgical methods for hysterectomy with staging for endometrial cancer: Robotic assistance, laparoscopy, laparotomy. Am J Obstet Gynecol. 2008; 199(4):360.
11. NCCN Clinical Practice Guidelines in Oncology (NCCN) 2.2016. Disponible en :URL: https://www.nccn.org/professionals/physician_gls/default.aspx
12. Frost JA, Webster K, Bryant A, Morrison J. Lymphadenectomy for the management of endometrial cancer. Cochrane Database Syst Rev. 2015;9:CD007585
13. Cordero J, López de la Manzanara C, García A, Garrido Esteban RA, Palomar Muñoz A, Talavera Rubio MP, et al. Estudio del ganglio centinela en estadios iniciales: resultados preliminares. Rev Esp Med Nucl Imagen Mol. 2012;31(5):243-248.
14. Torné A, Pahisa J, Vidal-Sicart S, Martínez-Roman, Paredes P, Puerto B, et al. Transvaginal ultrasound-guided myometrial injection of radiotracer (TUMIR): A new method for sentinel lymph node detection in endometrial cancer. Gynecol Oncol. 2013;128(1):88-94.
15. Querleu D, Cibula D, Abu-Rustum NR. 2017 Update on the Querleu-Morrow Classification of Radical Hysterectomy. Ann Surg Oncol. 2017;24(11):3406-3412
16. Ballester M, Dubernard G, Lecuru F, Heitz D, Mathevet P, Marret H, et al. Detection rate and diagnostic accuracy of sentinel-node biopsy in early stage endometrial cancer: A prospective multicenter study (SENTI-ENDO). Lancet Oncol. 2011;12(5):469- 476.
17. Creutzberg CL, van Putten WL, Koper PC, Lybeert ML, Jobsen JJ, Wárlám-Rodenhuis CC, et al. Surgery and postoperative radiotherapy versus surgery alone for patients with stage-1 endometrial carcinoma: Multicenter randomized trial. PORTEC Study Group. Post-Operative Radiation Therapy in endometrial carcinoma. Lancet. 2000;355:1404-1411
18. How J, Lau S, Press J, Ferenczy A, Pelmus M, Stern J, et al. Accuracy of sentinel lymph node detection following intra-operative cervical injection for endometrial cancer: A prospective study. Gynecol Oncol. 2012; 127: 332-337.
19. Solima E, Martinelli F, Ditto A, Maccauro M, Carcangiu M, Mariani L, et al. Diagnostic accuracy of sentinel node in endometrial cancer by using hysteroscopic injection of radiolabeled tracer. Gynecol Oncol. 2012;126: 419-23.
20. Berek JS, Howe C, Lagase LD, Hacker NF. Pelvic exenteration for recurrent gynecologic malignancy: Survival and morbidity analysis of the 45-year experience at UCLA. Gynecol Oncol. 2005;99:153-159.
21. Dowdy, SC, Mariani,A, Cliby,WA, Haddock MG, Petersen IA, Sim FH, et al. Radical pelvic resection and intraoperative radiation therapy for recurrent endometrial cancer: Technique and analysis of outcomes. Gynecol Oncol. 2006;101:280-286.
22. Memarzadeh S, Berek J. Uterine sarcoma: Classification, clinical manifestations and diagnosis. Disponible en: URL: https://www.uptodate.com/contents/uterine-sarcoma-classification-clinical-manifestations-and-diagnosis
23. Oncoguía SEGO: Sarcomas uterinos. Guías de práctica clínica en cáncer ginecológico y mamario. Publicaciones SEGO, 2014. Disponible en: URL: https://studylib.es/doc/4447458/oncoguia-sarcomas-2014.indd
Notas de autor
alfborges@hotmail.com