CASOS CLÍNICOS
Malaria Congénita
Congenital Malaria
Malaria Congénita
Salus, vol. 22, núm. 3, pp. 27-30, 2018
Universidad de Carabobo
Recepción: 01 Octubre 2018
Aprobación: 03 Diciembre 2018
Resumen: La Malaria es una enfermedad producida por el parásito Plasmodium spp. y transmitida por la picadura del mosquito Anopheles hembra. La infección por malaria durante la gestación determina un elevado riesgo de morbi-mortalidad tanto en la madre como en el feto. Se conoce que existe una mayor susceptibilidad de infección en primigestas y durante el segundo trimestre del embarazo. Se describe a continuación el caso de un recién nacido pre término de 16 días de vida producto de primigesta quien en el segundo trimestre del embarazo presento infección por Plasmodium vivax; el recien nacido ingresa por presentar episodios convulsivos, ictericia y hemoglobina de 6,8 g/dL, llegando a diagnóstico parasitológico a través de realización de gota gruesa. El tratamiento antimalárico al recién nacido fue realizado con cloroquina, con adecuada respuesta clínica, confirmada mediante negativización de gota gruesa al finalizar el mismo, dejando entrever la importancia en la actualidad de conocer, sospechar y descartar dicha patología, a través de una adecuada historia clínica, con relevancia en antecedentes familiares, para evitar consecuencias neonatales y aplicando tratamiento oportuno.
Palabras clave: Malaria congénita, recién nacido, Plasmodiumvivax, gota gruesa.
Abstract: Malaria is a disease caused by the parasite Plasmodium spp. and transmitted by the bite of the female Anopheles mosquito. Malaria infection during pregnancy determines a high risk of morbidity and mortality in both the mother and the fetus. It is known that there is a greater susceptibility to infection in primiparous women and during the second trimester of pregnancy. We describe below the case of a preterm newborn of 16 days of age, product of primigesta who in the second trimester of pregnancy presented infection by Plasmodium vivax; the newborn is admitted for presenting convulsive episodes, jaundice and hemoglobin of 6.8 gr / dl, reaching a parasitological diagnosis through thick blood. The newborn antimalarial treatment was performed with chloroquine, with an adequate clinical response, confirmed by thick-film negativization at the end of the treatment; revealing the importance nowadays of knowing, suspecting and discarding this pathology, through an adequate clinical history, with relevance in family history, to avoid neonatal consequences and applying timely treatment.
Keywords: Congenital malaria, Newborn, Plasmodium vivax, Coarse blood.
INTRODUCCION
La malaria, del italiano de la Edad Media malaria (mal aire), o paludismo, del latín palus (pantano), es una enfermedad parasitaria infecciosa, febril, causada por hemoparásitos del género Plasmodiumspp. que se transmiten a las personas por la picadura de la hembra de mosquito del género Anopheles infectado. Aunque existen más de 175 especies de Plasmodium spp., son cuatro las que se reportan como infectantes al humano: Plasmodiumfalciparum, Plasmodium vivax, Plasmodium malariae . Plasmodiumovaleque, el cual origina menos del 20% de los casos (1). En la Isla de Borneo, Asia, en los últimos años se ha incrementado el reporte de casos de malaria por Plasmodiumknowlesi, parásito del mono, causando síntomas en personas que viven muy cerca de monos (2).
El plasmodio y el hombre han compartido el planeta desde que hay noción de la historia escrita y ambos continúan en la lucha por sobrevivir. En el año 2.700 a. C. en China se describieron síntomas de esta enfermedad. En Grecia era reconocida desde el año 400 a. C. donde fue responsable de la declinación de muchas ciudades. En Europa, donde hoy nadie sospecharía un caso de paludismo, el plasmodio diezmó ejércitos y ocasionó epidemias devastadoras, pues no se disponía de medicamentos para su tratamiento, hasta que los misioneros jesuitas españoles aprendieron de los aborígenes peruanos el uso de la corteza de la quina (3).
En las Américas, aproximadamente la mitad de los casos de malaria ocurren en Brasil. El Plasmodium vivax es la especie más extendida geográficamente que infecta a los humanos (4).
Es la enfermedad tropical de mayor impacto en la salud mundial. Ocurren aproximadamente 300 a 500 millones de casos cada año, con cerca de un millón de defunciones. Muere un niño por malaria cada 30 segundos en algún lugar del planeta, 90% de estos casos en edades de 1 a 5 años en África, convirtiéndose en la infección que más niños mata en el mundo. Se estima que causa más de 300.000 muertes fetales e infantiles y 2.500 muertes de mujeres embarazadas en todo el mundo anualmente (3,5,6,7,8).
La información sobre malaria congénita en la literatura científica venezolana data desde 1917, con reportes hasta 1949 de aproximadamente once casos, coincidiendo con una de las etapas endémicas más importantes del país. Posteriormente 1992, Carvajal presentó 7 casos de paludismo congénito a nivel nacional y en el 2000 nuevamente Carvajal, Guerrero y Hernández presentaron un estudio retrospectivo (1992-1999), de 13 casos tratados en el Hospital “Menca de Leoni” en Ciudad Guayana, Estado Bolívar, Venezuela (9). En 2011 durante la semana de alerta epidemiológica N°11 se reportaron 974 casos de Malaria en todo el territorio nacional. Informes recientes han demostrado frecuencias que van del 3% al 54,2% entre los recién nacidos de madres que habían sufrido la malaria durante el embarazo (5,10). En Venezuela, en 1998, había 21.815 casos de malaria, y 2013 hubo un total de 76.621 casos notificados (5). En julio del 2013, en la emergencia pediátrica del Hospital Dr. J.M. Casal Ramos en la ciudad de Acarigua, estado portuguesa, ingresa un recién nacido (16 días) cuya madre fue diagnosticada con malaria a los 14 días postparto, con antecedente de haber vivido en el estado Bolívar durante la gestación. El paciente presentó fiebre y a nivel de los exámenes paraclínicos, anemia y trombocitopenia. Posteriormente se realizó gota gruesa y extendido que resulto positivo para Plamodium vivax, se cumplió tratamiento con cloroquina, seguido de mejoría y se egresó (8). En 2016 se presentó caso de un neonato de 26 días de vida con fiebre elevada, además de antecedentes maternos de malaria por Plasmodium vivax . Plasmodium falciparum durante la gestación, quien posterior a realizarse gota gruesa se aisló plasmodium vivax y se indicó tratamiento antimalárico logrando mejoría. (5)
La infección por malaria durante la gestación determina un elevado riesgo de morbimortalidad tanto en la madre como en el feto. Se conoce que existe mayor susceptibilidad de infección para Plasmodium falciparum. Plasmodium vivaxdurante la gestación, especialmente en primigestas y durante el segundo trimestre del embarazo. Parece que el riesgo de transmisión disminuye cuanto mayor sea la paridad debido al incremento de anticuerpos adquiridos. La infección materna por malaria se ha asociado a abortos, muerte fetal, anemia materna, retraso de crecimiento intrauterino, prematuridad, así como elevada morbimortalidad tanto de la madre como del recién nacido (11,12).
Aunque no existe un consenso claro acerca de la definición de malaria congénita, ésta se define como la malaria en el recién nacido adquirida directamente de la madre, ya sea intraútero o durante el parto. En zonas endémicas solo se considerará congénita aquella diagnosticada durante la primera semana de vida (3). La mayoría de los neonatos con malaria congénita están asintomáticos al nacimiento, apareciendo la clínica entre las 14 horas y las 8 semanas de vida, con una media de 10 a 28 días, (más precoz en zonas endémicas (primera semana de vida) y más tardía en no endémicas (hasta 8 semanas). La clínica es variable: fiebre, irritabilidad, rechazo del alimento, hepatoesplenomegalia, distrés respiratorio, ictericia, letargia, deposiciones dispépticas y palidez, así como alteraciones de laboratorios como anemia hemolítica, reticulocitosis y plaquetopenia (7,13,14).
Para poder llegar a un diagnóstico todo lo anterior debe ir acompañado de la confirmación parasitológica a través de: gota gruesa/frotis sanguíneo, el cual visualiza los parásitos (trofozoitos, esquizontes o gametos) e identifica la especie y el grado de parasitemia. Si el resultado es negativo y se mantiene la sospecha clínica, debe repetirse a las 12- 24 horas, mejor durante el pico febril. También existen las técnicas inmunocromáticas (test ICT, Optimal), los cuales son test rápidos que detectan antígenos de Plasmodiumfalciparum y Plasmodiumvivax en sangre (Fig.1).
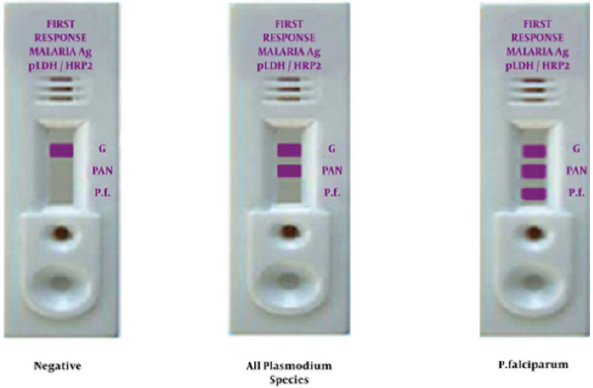
Fig.1
Pruebas diagnósticas rápidas para la malaria. (Fotografía cortesía de la Mashhad Universidad de Ciencias Médicas).
Son sencillos de realizar, no necesitan microscopio y tienen alta sensibilidad y especificidad (98%) cuando la parasitemia es alta, pero pueden dar falso negativo si esta es mínima. Por otra parte, se cuenta con la detección genómica por Reacción en Cadena de Polimesara (PCR), indicada ante parasitemias muy bajas, cuando la gota gruesa es falsamente negativa y ante la sospecha de parasitemia mixta (13,14).
El tratamiento irá encaminado hacia el estado de la malaria, sea complicada o no, dependiendo del compromiso clínico del paciente, teniéndose como base la combinación de fármacos, se debe realizar siempre con el niño ingresado para poder controlar tanto la evolución clínica como la tolerancia y la respuesta al tratamiento. A la hora de decidir es importante conocer cuál es la especie implicada y la zona de procedencia del niño para valorar la resistencia a antipalúdicos. Asimismo, se deben evaluar el estado clínico del paciente y los criterios de gravedad. Se recomienda realizar un electrocardiograma para el control de las alteraciones de la conducción si se administran determinados fármacos antipalúdicos como quinina, cloroquina o mefloquina (15).
La malaria congénita debe incluirse en el diagnóstico diferencial de la sepsis neonatal tardía y de otras infecciones de transmisión vertical como el TORCHS, y en aquellos pacientes hijos de madres procedentes de zonas endémicas de malaria independientemente de si han sido sintomáticas o no durante la gestación (13).
CASO CLÍNICO
Se trata de recién nacido masculino de 16 días de nacido procedente de Municipio Guacara - Edo. Carabobo, producto de madre de 15 años de edad primigesta, embarazo no controlado, con antecedente de Paludismo (Plasmodiumvivax) en el 2do. trimestre del embarazo quien recibió tratamiento con cloroquina a dosis que desconoce. Además, refirió visita al estado Bolívar durante la gestación, a su vez abuela materna que presento episodios de paludismo en muchas ocasiones.
Examen Físico: FC: 145 lpm, FR: 39 rpm, Temp: 37 °C, Peso: 1.900 g, Talla: 41cm. Piel normotérmica al tacto con tinte ictérico de piel y mucosas, Kramer IV/V, llenado capilar 3seg. normocéfalo, perímetro cefálico 29 cm, fontanela anterior normotensa de 2x2cm. Ojos simétricos con tinte ictérico de conjuntiva, pupilas isocoricas normoreactivas a la luz. Abdomen blando, sin hepatomegalias. Neurológico hipoactivo, llanto y succión débil, reflejos arcaicos presentes.
Evolución Intrahospitalaria: Paciente quien ingresa con diagnóstico de sepsis neonatal tardía, con laboratorios que reportaron anemia y trombocitopenia planteándose realizar pancultivos según protocolo, a su vez se indica cobertura antimicrobiana con Ampicilina y Cefotaxime. En vista de nexo epidemiológico se plantea Malaria congénita, por lo cual 3 días posterior a ingreso (06/03/2018) se le realiza Gota gruesa, resultando positivo para Plasmodium vivax, siendo indicado por el servicio de Epidemiologia tratamiento con cloroquina, primeros 2 días a 10 mg/kg/día y el 3er. día a 5 mg/kg/día.
Posterior a recibir tratamiento se evidencia mejoría clínica del recién nacido, logrando mejorar valores de Hemoglobina y plaquetas. Se realiza gota gruesa control el 09/03/2018 resultando negativo. Superado el cuadro clínico del recién nacido es egresado, permaneciendo en control con el servicio de epidemiologia del centro
-
Ecografía abdominal: vesícula biliar con escaso barro biliar, sin visceromegalias.
-
Ecografía transfontanelar sin alteración.
-
Hemocultivos negativos.
DISCUSION
A pesar de los programas de control de Malaria a nivel nacional continúa la problemática, en vista que son muchas las embarazadas que no escapan a la problemática siendo susceptibles a la infección por lo cual la malaria congénita tiene una gran incidencia. Existe la opinión general de que el paludismo congénito es raro, inclusive en áreas endémicas, pero la aparición de casos nos demuestra las graves consecuencias que ocurren (16,17).
Se da importancia a este contenido en vista de la relevancia en la actualidad de recién nacidos con malaria congénita. El caso presentado, describe a un neonato con infección comprobada de malaria congénita por Plasmodiumvivax, producto de primigesta quien viajó a región endémica, presentando posteriormente síntomas relacionados con malaria por lo cual cumple tratamiento durante el segundo trimestre de gestación. Presenta trabajo de parto pretérmino y previo a egreso realizan gota gruesa, encontrándose negativa tanto para madre como para recién nacido.
El inicio clínico de la enfermedad en un recién nacido congénitamente infectado puede retrasarse durante semanas, la mayoría de las cuales presentan entre 10 y 28 días de vida. El paciente en estudio se volvió sintomático a los 16 días de vida y comenzó a presentar síntomas asociados con malaria y además presento una muestra de gota gruesa positiva. Refiere la literatura que al recién nacido se le debe realizar control de gota gruesa a los 10 a 15 días de nacido inclusive sin presentar sintomatología (18).
El tratamiento de este recién nacido por su malaria congénita por Plasmodiumvivax amerito un esquizonticida como lo es la cloroquina, lo cual coincide con otros reportes (6,18,19,20).
En estos pacientes la primaquina es innecesaria, ya que en la malaria congénita el parásito no hace fase hepática en vista de la inmadurez hepática neonatal. Posterior a cumplir tratamiento con cloroquina presento mejoría clínica y paraclínicos con aumento de valores de hemoglobina y plaquetas por lo cual al tener cultivos negativos es egresado. En general, la infección por Plasmodium vivax no es grave y la mortalidad es muy baja. Sin embargo, las complicaciones como la anemia severa y la hemorragia siempre deben tenerse en cuenta en los niños más pequeños. Dado el aumento de la migración nacional, el paludismo es un diagnóstico diferencial que debe tenerse en cuenta en recién nacidos con sepsis o fiebre de origen desconocido en aéreas no endémicas (19). En caso de detección inicial negativa de malaria, se debe repetir el cribado.
CONCLUSIONES
Este caso nos muestra la importancia de conocer de forma detallada los antecedentes obstétricos y perinatales de los recién nacidos para enfocar la clínica del paciente a un diagnóstico certero y de esta forma cumplir tratamiento y conductas adecuadas. A pesar de que la gestante no presento sintomatología, teniendo antecedentes de viaje a zonas endémicas, se debe hacer descarte de malaria al nacimiento y seguimiento de los mismos. La malaria congénita es un importante problema de salud pública relacionado con la mortalidad perinatal, que, pese a los programas de control implementados por el estado, siguen siendo los movimientos migratorios los responsables de la prevalencia de dichos casos. De esta forma es necesario en todos los controles prenatales desde los centros de salud primario o de alto riesgo conocer detalladamente antecedentes familiares y viajes que realice la gestante para mantener una alerta epidemiológica. Finalmente, la malaria se debe considerar como un importante diagnóstico diferencial de infecciones neonatales y sepsis en recién nacidos que nacen de madres provenientes de aéreas con malaria endémica con o sin una historia obvia bien conocida de la malaria durante el embarazo. De allí que resulta indispensable que toda mujer que tenga antecedente de viaje a zona endémica haya o no presentada sintomatología amerita realizar prueba de gota gruesa para el descarte de malaria.
REFERENCIAS
1. Silva H, Laulate B, Coral C. Malaria congénita en un Hospital de Iquitos, Perú. Rev. MedExp Salud Pública [Internet] 2015 [Consultado Marzo 2018]; 32 (2): 259-264.
2. Ministerio del Poder Popular para la Salud. Programa Nacional de Eliminación de Malaria: Pautas de tratamiento en casos de malaria. [Internet] Caracas 2017. [Consultado febrero 2018] Disponible en: https://www.paho.org/ven/ index.php?option=com_docman&view=doenload<em id=466&alias=105-pautas-de-tratamiento-de-casos-de-malaria&category_slug=malaria-pautas-de-tratamiento
3. Barreto M. Malaria en la niñez. Sociedad Colombiana de Pediatria. [Citado marzo 2018]. Disponible en: https://scp.com. co/precop-old/precop_files/modulo_5_vin_1/496
4. Siqueira A, Coutinho L, Gurgel R, Cs Su W, Carvalho L, Benzecry S. Slow clearance of Plasmodium vivax with chloroquine amongst children younger than six months of age in the Brazilian Amazon. MemInst 2014; 109 (5):540-545.
5. Echenique Y, González G, Oberto K, Fajardo R. Malaria congénita. A propósito de un caso. ArchVenezPuerPed 2016; 79 (2):74-76.
6. Preeti R, Kaushik M, Sunita S, Richa C, Jagdish C. Congenital malaria in a neonate: case report with a comprehensive review on differential diagnosis, treatment and prevention in Indian perspective. J Parasit Dis 2015; 39 (2):345–348.
7. Seth S, SadhukhanS, Das R, Biswas B. Congenital Plasmodium Vivax Malaria with maternal TORCH Infection–A Diagnostic Dilemma. Journal of Dental and Medical Sciences 2016; 15 (10):67-69.
8. Marruffo M, Guevara M. Malaria Congénita por Plasmodium vivax. Comunidad y Salud 2015; 13 (1)56-59.
9. Carvajal C, Guerrero M, Hernández A. MALARIA CONGÉNITA. ESTUDIO RETROSPECTIVO 1992-1999. HOSPITAL “MENCA DE LEONI”. 2001; 64 (1): 37-43.
10. Piñeros J, Álvarez G, Tobon A, Arboleda M, Carrero S, Blair S. Congenital malaria in Uraba, Colombia. Malar J 2011; (10):239-250. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/ articles/PMC3177814/
11. Malaria de transmisión vertical. Protocolo Diagnostico- Terapéutico. Unidad de patologia infecciosa e inmudeficiencias de Pediatria 2014 V (3) 2-6.
12. Brutus L, Santalla J, Schneider D, Avila J, Deloron P. Plasmodium Vivax Malaria during Pregnancy, Bolivia. Emerg Infect Dis. 2013; 19(10): 1605–1611.
13. López M, García M, Mellado M, Arrieta J. Patología infecciosa importada I: Malaria. Protocolos diagnóstico-terapéuticos de la AEP. Madrid. Servicio de Pediatría. Unidad de Enfermedades Infecciosas y Pediatría Tropical. 221 - 229
14. Tao Z-y, Fang Q, Liu X, Culleton R, Tao L, Xia H, et al. (2014) Congenital Malaria in China. PLoS Negl Trop Dis
15. Tao Z, Fang Q, Liu X,Culleton R, Tao L, Xia H. Congenital Malaria in China. PlosNeglTropDis 2014; 8(3): e2622. doi: 10.1371/journal.pntd.0002622
16. Carvajal C; Guerrero C, Merys J; Hernández A. Malaria Congénita. Estudio retrospectivo 2000-2011. Hospital “Menca de Leoni”. Ciudad Guayana-Estado Bolívar. ArchVenezPuerPed 2012; 75 (4): 96-99.
17. Rodríguez A, Paniz A. Venezuela´sfailure in malaria control. The Lancet 2014;(384): 663-664. Disponible en: https://doi. org/10.1016/S0140-6736(14)61389-1
18. Sánchez H, Uribe M, Bustamante A, Uribe P. Malaria Congénita por Plasmodium Vivax: un caso incidental en contexto de sepsis neonatal. BOLPEDIATR 2012; 52: 33-36.
19. Gathwala G, Dalal P, Gupta M. Congenital malaria with atypical presentation: A series of three case reports. Journal of Clinical Neonatology 2015; 4 (3): 206-208.
20. Utgers M, Clemens S, Winter J, Sloot S, Jager M , Mank T. Congenital Plasmodium Vivax Malaria in a Non- Endemic Country; A Unique Case in the Netherlands. PediatricInfectDis 2017;(2):33 .
21. Contreras A, Camacho G, Rojas E. Paludismo congénito complicado debido a Plasmodium Vivax. Case reports 2015; 1 (1): 8-11.
Notas de autor