BETALAÍNAS EM BETERRABA MINIMAMENTE PROCESSADA: PERDAS E FORMAS DE PRESERVAÇÃO
BETALAINS IN BEET ROOT FRESH-CUT: LOSSES AND PRESERVATION METHODS
BETALAÍNAS EM BETERRABA MINIMAMENTE PROCESSADA: PERDAS E FORMAS DE PRESERVAÇÃO
Revista Iberoamericana de Tecnología Postcosecha, vol. 17, núm. 2, pp. 175-192, 2016
Asociación Iberoamericana de Tecnología Postcosecha, S.C.
Resumo: A beterraba é uma hortaliça rica em propriedades nutricionais, antioxidantes e funcionais, sendo consumida, principalmente, na forma in natura, cozida ou minimamente processada. Sua coloração é decorrente do alto teor de seu principal composto funcional, as betalaínas, que são pigmentos hidrossolúveis presentes em todos os tecidos da beterraba. Os produtos minimamente processados (PMPs) estão cada vez mais presentes no dia a dia dos consumidores que os associam à praticidade e a uma alternativa rápida, segura e saudável no consumo de frutas e hortaliças. No entanto, várias respostas dos PMPs são desencadeadas em função dos danos sofridos durante seu preparo, o que dispara várias reações relacionadas com a fisiologia do estresse, das quais os tecidos buscam se recuperar. Com isso há aumento da taxa respiratória, ativando o metabolismo secundário e, por consequência disso, gastando rapidamente suas reservas. A perda dos pigmentos é o principal fator que deteriora a qualidade de beterraba minimamente processada, causando perdas ao nível nutricional e visual. Diante disso, algumas técnicas preconizam a menor perda possível dos principais compostos funcionais e de qualidade durante o preparo e armazenamento dos alimentos. Estratégias para reduzir as perdas envolvem desde o fluxograma de preparo até o armazenamento e embalagem adequados. Também, podem ser utilizados aditivos e tecnologias emergentes como a radiação gama, que podem ser úteis na manutenção das características qualitativas dos alimentos.
Palavras-chave: Beta vulgaris, capacidade antioxidante, betanina, betacianinas, betaxantinas.
Abstract: Beetroot is a nutritionally rich vegetable, with high antioxidants and functional properties, consumed as fresh, cooked or fresh-cut. The color of beetroot is due to the high content of its main functional compound, the betalains, which are a water soluble pigments present in practically all its tissues. Minimally processed products (MPPs) are increasingly present in the daily lives of consumers, who look for these products because of their practicality and fast, safe and healthy form of fruits and vegetable consumption. However, there are several alterations in response to damage suffered during their preparation, which triggers various reactions related to the stress physiology, so to recover from stress. With that there is increased respiratory rate, activating the secondary metabolism, in consequence of that spending quickly your reservations. The losses of pigments is factor director that deteriorates the product quality, causing losses nutritional and visual level. Thus, some techniques advocate the least possible loss of the principal functional compounds and quality during the preparation and storage of food. Strategies to reduce the losses involved from the preparation of flow chart to the storage and suitable packaging. Also, additives and emerging technologies such as gamma radiation, which may be useful in maintaining the quality characteristics of foods can be used.
Keywords: Beta vulgaris, antioxidant capacity, betanina, betacyanins, betaxanthins.
INTRODUÇÃO
A beterraba é uma hortaliça amplamente consumida no mercado brasileiro, devido a sua aceitabilidade e retorno financeiro, sendo comercializada como produto inteiro a granel ou minimamente processada (Barry-Ryan et al., 2007). A expansão do mercado de PMPs associadas à coloração e sabor característicos da beterraba permite sua exploração em diferentes setores como varejo, mercado institucional e indústrias alimentícias (Gomes et al., 2014).
A coloração púrpura característica das beterrabas é resultante da alta concentração de betalaínas, pigmentos nitrogenados hidrossolúveis, sintetizados pelo metabolismo secundário presentes em todos os órgãos da planta e armazenados principalmente no vacúolo das células (Wink, 1997; Strack et al., 2003). São importantes compostos para a indústria, utilizados principalmente como corantes em alimentos e como compostos antioxidantes em suplementos para atletas ou fortificantes nutricionais de alimentos processados (Amnah, 2013). São compostos funcionais importantes para a saúde humana, atuando principalmente na inibição da peroxidação lipídica, aumento da resistência à oxidação de lipoproteínas de baixa densidade (LDL), além de apresentar efeitos quimio- preventivos e antimicrobianos (Wu et al., 2006; Gengatharan et al., 2015). Ainda, estas substâncias são cotadas para desempenhar papel importante em neutralizar o estresse oxidativo, uma vez que se mostram capazes de modular o desiquilíbrio entre as espécies oxidantes e o sistema de defesa antioxidante. Estes compostos apresentam efeito protetor do DNA, diminuindo os danos ocasionados pelo peróxido de hidrogênio na molécula (Esatbeyoglu et al., 2014), assim como a sua clivagem (Sakihama et al., 2012).
Devido ao grande potencial antioxidante, as betalaínas ganharam novamente destaque na área de pesquisa nos últimos anos, apresentando grandes contribuições para o entendimento das perdas por meio dos processos oxidativos nas plantas. Apesar de apresentar baixa estabilidade térmica (Cardoso-Ugarte et al., 2014), as betalaínas possuem capacidade antioxidante 1,5 a 2,0 vezes maior que as antocianinas, quando analisadas em pH 3,0 a 7,0, uma vez que as betalaínas mantem a estabilidade e a capacidade antioxidante nesta faixa de pH (Borkowski et al., 2005).
A fisiologia dos produtos minimamente processados corresponde à fisiologia de tecidos vegetais que sofreram injúrias. Ao longo do processamento são realizadas etapas de descascamento, corte e centrifugação que desencadeiam respostas ao estresse como aumento da respiração, estímulo à formação de metabólitos secundários de defesa e reações de oxido-redução. Igualmente, favorecem a perda dos pigmentos por lixiviação, o que somada à desidratação do produto ao longo do armazenamento, ocasiona um dos principais problemas para beterraba minimamente processada que é a perda de betalaínas e o esbranquiçamento superficial (Kluge et al., 2006, Kluge et al., 2010; Vitti et al., 2004).
A conservação das betalaínas na beterraba minimamente processada está sujeita à ação de fatores prejudiciais, como a oxidação enzimática, degradação por temperatura, exposição à luz e ao oxigênio (Herbach et al., 2007). Tecnologias alternativas estão sendo desenvolvidas para minimizar estas perdas ao longo do processamento e armazenamento. Entender quais são os pontos críticos para estabilidade das betalaínas é o principal passo para melhorar as estratégias de conservação do pigmento. Assim, a aplicação de produtos químicos, tratamentos térmicos e não- térmicos, além da manutenção da temperatura e atmosfera ideal, estão sendo estudados e têm apresentado resultados promissores para aperfeiçoar as técnicas de processamento mínimo e alavancar o mercado para esta hortaliça.
FATORES QUE AFETAM A CONSERVAÇÃO DAS BETALAÍNAS AO LONGO DO PROCESSAMENTO MÍNIMO DE BETERRABA
A beterraba púrpura (Beta vulgaris spp. vulgaris) pertence à família Quenopodiaceae. Comumente chamada de “raiz” tuberosa, é botanicamente classificada como tubérculo hipocotiledonar, sendo que as raízes verdadeiras se desenvolvem na porção terminal do órgão (Appezatto-Da-Glória, 2015). É originária de regiões de clima temperado da Europa e do Norte da África, onde é muito utilizada para produção de açúcar (beterraba açucareira) e como planta forrageira (Kapadia e Rao, 2013). No Brasil, as principais cultivares plantadas são as beterrabas de coloração púrpura, com a finalidade de consumo in natura ou industrial (Kluge et al., 2005).
Esta hortaliça é comumente comercializada como produto inteiro ou minimamente processadas. O maior mercado consumidor de produtos minimamente processados (PMPs), ainda são as redes de fast foods, com constante expansão de consumo no varejo e nas redes de food service (Barry-Ryan et al., 2007; Latorre et al., 2010). O processamento mínimo possibilita ao consumidor, além da economia de tempo, redução da produção de resíduos, maior praticidade de consumo e facilidade no preparo, importantes características para o nicho de mercado atual, que busca aliar melhorias na qualidade nutricional das refeições com a conveniência dos produtos (Gomes et al., 2014).
A qualidade nutricional da beterraba está relacionada principalmente as vitaminas, minerais e compostos bioativos presentes na raiz tuberosa. Esta hortaliça também se destaca pela alta capacidade antioxidante proporcionado pelos pigmentos denominados betalaínas responsáveis pela coloração púrpura característica das beterrabas (Escribano et al., 1998; Kanner et al., 2001; Pedreño e Escribano, 2000; Strack et al., 2003). As betalaínas são pigmentos nitrogenados hidrossolúveis, sintetizados pelo metabolismo secundário e estão presentes em todos os órgãos da planta e armazenados no vacúolo das células (Wink, 1997). Estes pigmentos são restritos às plantas da ordem Caryophyllales e fungos dos gêneros Amanita e Hygrocybe (Gandia-Herrero et al., 2005). Em proporções, as betalaínas representam cerca de 1% da base seca de raízes frescas (Herbach et al., 2004).
Apesar das facilidades que os PMPs trazem, há perdas durante seu preparo e armazenamento. O processamento mínimo implica em processos de modificação e adequação dos produtos para consumo imediato, sendo assim, é uma ação que apresenta causa e efeitos sobre os alimentos manipulados (Figura 1). A beterraba minimamente processada é submetida ao descascamento e ao corte, sendo suas principais fontes de estresse mecânico. Além do tecido injuriado, as etapas de sanitização e enxague predispõem o produto à perda de pigmentos e outros compostos hidrossolúveis, facilmente liberados do tecido lesionado. A camada superficial de células do PMP fica totalmente predisposta à desidratação e deterioração aceleradas. Mesmo órgãos de reserva como bulbos, rizomas e tubérculos apresentam perecibilidade alta, principalmente comparados ao produto inteiro (Vitti et al., 2004; Kluge et al., 2005). Porém, não podemos dispensar a sanitização e enxague, já que são etapas cruciais para a segurança de consumo do alimento.
A extensão das perdas de betalaínas pode variar de 30% com a retirada da casca (Kapadia e Rao, 2013) à 50% após o processamento. Esta elevada perda decorre do fato de que todas as etapas do processamento direcionam à perda do pigmento, desde o descascamento até o enxague. O descascamento é a primeira etapa para a produção de PMPs, sendo que em beterraba a concentração dos pigmentos aumenta do centro para a periferia. Desta forma, esta etapa causa uma das maiores extensões de perdas por tecido lesionado. O método de descascamento empregado ocasiona lesões com amplitudes diferentes, sendo que a magnitude de perda de betalaínas, assim como a taxa de respiração foram cerca de três vezes mais acentuadas em beterrabas descascadas utilizando disco abrasivo em comparação ao descascamento manual (Kluge et al., 2005). Uma vez sob estresse e somado à descompartimentalização celular, enzimas oxidativas como a polifenoloxidase (PPO) e a peroxidase (POD) apresentam alta atividade na região próxima a casca. Estas enzimas atuam para minimizar a ação de espécies reativas de oxigênio e utilizam fenóis como substrato da reação e/ou as próprias betalaínas, ocasionando sua degradação (Kapadia e Rao, 2013). Além disso, imediatamente após o descascamento, ainda inteiras, as beterrabas são submetidas à primeira sanitização. O contato com a solução ocasiona novamente a perda dos pigmentos hidrossolúveis das células lesionadas da superfície, entretanto, nesta etapa as perdas não são tão expressivas, quanto às do descascamento (Vitti et al., 2004; Kluge et al., 2008).
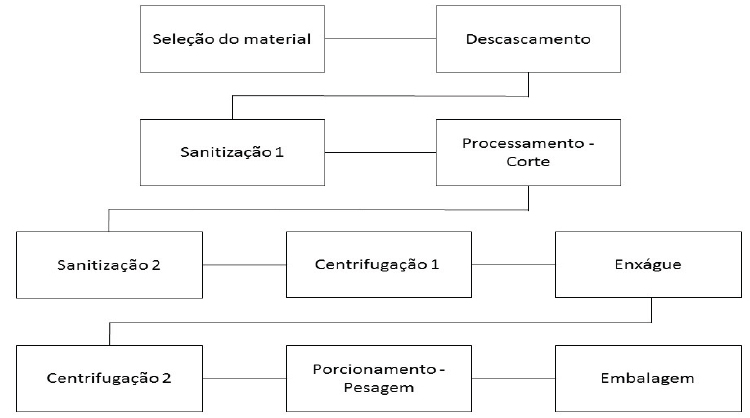
Figura 1
Fluxograma de preparo de beterraba minimamente processada (adaptado de Vitti, 2003)
Por seguinte, a modulação da hortaliça nas diferentes formas de apresentação do produto, origina diferentes níveis de perdas, sendo relacionados ao tipo de corte, mas principalmente ao tamanho final do produto. O corte propicia o aumento da superfície de contato com a atmosfera e, consequentemente, cria uma nova face de células rompidas, que extravasam o conteúdo celular (Vitti et al., 2004). Os PMPs de beterraba são comumente apresentados no mercado na forma de retalhos de 2 mm de espessura (Kluge et al., 2005), podendo também ser encontrados em menor frequência no formato de cubos ou discos horizontais. O formato da beterraba minimamente processada também pode afetar a concentração de pigmentos, sendo que formatos em discos apresentaram perdas de betalaínas logo após o processamento 30% menores às observadas no formato em retalhos, e 50% menores após um período de 10 dias (Kluge et al., 2006).
A etapa seguinte da sanitização apresenta a maior extensão de perdas do processo, onde o tecido fracionado é novamente imerso em solução aquosa para efetuar a última sanitização do PMP. Os pigmentos são perdidos na mesma proporção em que é realizado o corte, ou seja, o tamanho final do produto é diretamente proporcional às perdas. Por último, o enxágue realizado retira o excesso do sanitizante e novamente os pigmentos são perdidos na solução. Os processos seguintes de centrifugação retiram o excesso de umidade e, consequentemente, o pigmento diluído nele. Para tanto, ao final do processo uma grande extensão de perdas ocorre, ocasionadas pelas várias etapas de corte, sanitização e enxágue. Vitti et al., (2004) relatam que o maior número de sanitizações após o corte favorece a perda da intensidade de coloração do produto, mas que a perda ao longo do armazenamento é inevitável, independentemente do número de lavagens do produto. Além da perda de pigmentos outros compostos antioxidantes importantes são perdidos durante o processamento, como muitos compostos fenólicos hidrossolúveis (Picoli et al., 2010).
Ainda, são apontadas perdas nutricionais ao longo do armazenamento, ocasionadas pelo estresse durante o processamento, desencadeando reações catabólicas, como a oxidação dos vários compostos funcionais e antioxidantes da hortaliça, mesmo em condições ideais de resfriamento (Chitarra e Chitarra, 2005). O dano mecânico causado pelo corte ou descascamento é um dos maiores obstáculos na conservação dos produtos minimamente processados e a taxa respiratória destes produtos é de três a cinco vezes maior que a de órgãos intactos. Além de que, para beterrabas, tem sido notória a perda de qualidade relativa à coloração, pois durante os processos de lavagem, sanitização e enxague grande parte da pigmentação é lixiviada e devido ao corte ocorre a saída do suco celular para o exterior, promovendo a desidratação do tecido vegetal ao longo do armazenamento (Vitti et al., 2004).
Os PMPs são dependentes de uma cadeia de frio desde imediatamente após a colheita até a comercialização. O controle de temperatura minimiza os efeitos do processamento, principalmente quanto à aceleração do metabolismo, que envolve aumento da taxa respiratória, ação de enzimas oxidativas e proliferação de micro-organismos. Vitti et al. (2005) compararam temperaturas de armazenamento para beterraba minimamente processada e observaram que o metabolismo é drasticamente acelerado nos primeiros dias de armazenamento à 15º C, consistindo em taxa respiratória duas vezes maior do que quando mantidas à 5°C, com pico entre o primeiro e terceiro dia. Assim, a estabilidade dos betalaínas é afetada ao longo do tempo pelos processos de degradação, principalmente, em função da produção de espécies reativas de oxigênio (ROS) e das enzimas oxidativas, sendo degradados ao longo do armazenamento. Este comportamento característico durante o armazenamento do vegetal também foi observado por outros autores, que constataram perda de 40% de betalaínas após 7 dias de armazenamento sob temperatura de 0°C (Osornio e Chaves, 1998) e perdas de 50% após 10 dias de armazenamento à 5°C que, entretanto, foram maiores durante o período de preparo do PMP (Picoli et al., 2010).
A vida útil de beterraba minimamente processada está relacionada principalmente ao estado visual do produto e à segurança do alimento. No entanto, um produto de qualidade também deve levar em consideração a manutenção nutricional e de compostos bioativos. Levando em consideração todos os aspectos, o tempo de 4 a 6 dias de vida útil sob refrigeração garantem uma relativa manutenção da qualidade do PMP (Kluge et al., 2005).
Betalaínas em beterraba
A cor púrpura da beterraba é devido aos pigmentos alcaloides provenientes do metabolismo secundário, denominados betalaínas (Wink, 1997; Strack et al., 2003). A beterraba vermelha (Beta vulgaris L.) é o principal e mais popular fonte destes pigmentos e está alocada na Ordem Caryophyllales, que inclui também, representantes no gênero Amaranthus, Bougainvillea, (Stintzing e Carle, 2008) Amanita e Hygrophorus (Heuer et al., 1994).
Betalaínas e antocianinas são pigmentos exclusivos em plantas, ou seja, os dois juntos jamais ocorrem em uma mesma espécie.
Apesar da estrutura e funções muito similares, a síntese de betalaínas ainda não está bem elucidada. No entanto, é conhecido que a expressão de muitos genes envolvidos na síntese de antocianinas não ocorre para as betalaínas (Shimada et al., 2007; Brockington et al., 2011). Esta singularidade é citada como a ausência da enzima antocianidina sintase, que catalisa o último passo da síntese de antocianinas (Moreno et al., 2008). Além disso, o precursor das betalaínas é o aminoácido tirosina e das antocianinas a fenilalanina (Brockington et al., 2011). Ambos os pigmentos são hidrossolúveis vacuolares (Reddy et al, 2005), sendo melhor dissolvidos em água. No entanto, betalaínas apresentam menor solubilidade em álcoois polares em comparação às antocianinas (Stintzing et al., 2006).
As betalaínas têm estrutura química característica diferenciada dos outros pigmentos de cor similar, como as antocianinas e flavonoides, por apresentarem dois átomos de nitrogênio no seu esqueleto carbônico básico. Sua estrutura molecular básica comum consta de um cromóforo, o ácido betalâmico (Kapadia e Rao, 2013).
Mais de 70 betalaínas já são conhecidas (Bobbio e Bobbio, 1984; Tanaka et al., 2008) e são divididas em dois grupos de acordo com sua estrutura química: as betacianinas (coloração vermelho-violeta) e as betaxantinas (coloração amarela) (Delgado-Vargas et al., 2000; Gandia-Herrero et al., 2005). São caracterizadas por apresentar a mesma estrutura básica ‒ o ácido betalâmico ‒ diferindo nos componentes de seus radicais R1 e R2, que podem ser hidrogênio ou um aromático substituinte, sendo que sua cor é atribuível às ligações duplas ressonantes (Delgado-Vargas et al., 2000). A beterraba vermelha apresenta diferentes tonalidades que são correlacionadas à taxa de concentração de cada classe do pigmento, onde aproximadamente 0,04%-0,21% correspondem às betacianinas e 0,02%-0,14% são betaxantinas, totalizando 35 a 120 mg 100 g-1 de peso fresco de betalaínas da hortaliça (Nilsson, 1970). Quanto à produtividade de beterraba esta fica em torno de 50 a 70 t ha-1, sendo que o conteúdo de betanina corresponde de 40 a 200 mg por 100g de peso fresco e 0,4-20 mg por g de peso seco-1. A quantidade depende muito do cultivo, da idade do vegetal e principalmente do potencial do cultivar (Kapadia e Rao, 2013).
A coloração vermelha das betacianinas é caracterizada pela condensação do ciclo-DOPA (ciclo-dihydrophenylalanine) ou 2-descarboxy- ciclo-DOPA com o ácido betalâmico caracterizando as betacianinas agliconas (Strack et al., 2003; Tanaka et al., 2008). A partir desta estrutura básica, que caracteriza a betanidina, pela variação no padrão do esqueleto carbônico é possível um número considerável de diferentes betacianinas. Sua estrutura apresenta diferenciação quanto à glicosilação em uma das posições, formando 5-O ou 6-O-glicosídeos, nos grupos hidroxila da molécula (Delgado-Vargas et al., 2000; Herbach et al., 2006a; Kapadia e Rao, 2013). Além disso, estes monossacarídeos também podem ser acilados, obtendo-se variação na estrutura que, consequentemente, promovem desvio de absorção máxima nas betacianinas (Herbach et al., 2006b).
Em proporções, cerca de 80-90% do total de pigmentos em beterraba vermelha são betacianinas, com maior concentração de betanina (betanidina-5-O-glicosideo) e seu isômero isobetanina (isobetanidina-5-O-glicosideo) (Kujala et al., 2001; Herbach et al., 2006b), seguido das betanidinas, prebetaninas e seus isômeros C-15 (Knuthsen, 1981). A distribuição de betanina na hortaliça não é uniforme, decrescendo da casca ao centro (Kujala et al., 2000; Kujala et al., 2002), no entanto alcança concentrações de 300-600 mg Kg-1 de beterraba vermelha (Kanner et al., 2001).
A classe de pigmentos que proporciona a coloração amarela das betalaínas é for mada pelo mesmo cromóforo base das betacianinas, o ácido betalâmico que forma uma estrutura base a dihydropyridina (Delgado-Vargas et al., 2000). As betaxantinas diferem das betacianinas pela conjugação exclusiva com aminoácidos e aminas, o que fornece a variabilidade na estrutura da molécula (Stintzing, 2002). Os aminoácidos podem ser proteinogênicos ou não-proteinogênicos (Delgado-Vargas et al., 2000). Esta variação confere um desvio de absorbância de 460 a 480 nm entre as moléculas (Stintzing, 2002). As betaxantinas mais abundantes em beterraba vermelha são a vulgaxantina I e II (Gliszczynska-Swigło et al., 2006; Herbach et al., 2006b; Azeredo, 2009) que são moléculas conjugadas de glutamina-betaxantinas (Gasztony et al., 2001) e a indicaxantina, conjugada com prolina (Kujala et al., 2001; Herbach et al., 2006a).
As diferenças na estrutura das duas classes interferem diretamente no seu potencial antioxidante, estabilidade e na sua atividade anti-radicalar, nas quais o maior número e posição dos grupos hidroxial e resíduos de imino intensifica a capacidade antioxidante (Escribano et al., 1998; Pedreño e Escribano, 2001; Cai et al., 2003; Gandia-Herrero et al., 2010; Gandia-Herrero et al., 2013). As betacianinas apresentam maior atividade anti-radicalar que as betaxantinas (Cai et al., 2003; Gandia-Herrero et al., 2009), em função do grupamento fenólico, ausente nas betaxantinas (Gandia-Herrero et al., 2009). Para betacianinas, a atividade anti-radicalar está relacionada aos processos de glicosilação (Cai et al., 2003; Gandia-Herrero et al., 2010) e acilação, onde o primeiro reduz e o segundo geralmente melhora a atividade antioxidante. Além disso, a posição de glicosilação afeta a atividade antioxidante em direções opostas, em que moléculas 6-O-glicosiladas apresentam valores antioxidantes mais elevados que as 5- O-glicosiladas, e assim como as agliconas com grupo hidroxílico na posição C-5 apresentam melhora na atividade antioxidante (Cai et al., 2003).
Devido às diferenças estruturais entre betacianinas e betaxantinas, que além de apresentarem diferenças na atividade anti- radicalar, também são distintas quanto à estabilidade das moléculas. As betacianinas são significantemente mais estáveis que as betaxantinas, tanto em temperatura ambiente (Sapers e Hornstein, 1979) quanto após aquecimento (Singer e von Elbe, 1980; Herbach et al., 2004). Quando comparada a estabilidade de diferentes betacianinas, observa-se que a glicosilação da estrutura oferece maior estabilidade à molécula, promovendo maior potencial oxido-redutor (von Elbe e Attoe, 1985).
A glicosilação pode ocorrer em duas etapas da síntese dos pigmentos, tanto no início, a nível ciclo-DOPA ‒ antes mesmo do acoplamento com o ácido betalâmico, ‒ quanto nas etapas finais, após a completa formação da betanidina (Roberts et al., 2010). A melhora no potencial de oxidação não está diretamente relacionada ao número de resíduos de açúcar, dependendo de outros fatores da estrutura dos diferentes pigmentos. Esta melhora de estabilidade pode atingir valores de meia vida discrepantes entre as formas glicosilada (betanina) e sua aglicona (betanidina), chegando a ser até 17 vezes maior (Huang e von Elbe, 1986). No entanto, outros fatores como esterificação com ácidos alifáticos (Reynoso et al., 1997; Garcia-Barrera et al, 1998), assim como com ácidos aromáticos, sobretudo na posição 6-O (Heuer et al., 1994; Schliemann e Strack, 1998) favorecem ao aumento da estabilidade das betacianinas. Além disso, a acilação previne a degradação dos pigmentos, pela ação da enzima hidrolítica β-glicosidase endógena ou exógena (Minale et al., 1966). Outras enzimas como a PPO e POD, estão entre as principais enzimas oxidativas em beterraba vermelha, sendo que suas ações predispõem a degradação e/ou oxidação dos pigmentos e, consequentemente, perda de coloração do PMP (Lee e Smith, 1979; Martinez-Parra e Muñoz, 2001; Escribano et al., 2002).
A alta capacidade antioxidante confere propriedades nutracêuticas às betalaínas. Conforme relatado, usando espectroscopia de ressonância de spin eletrônico, estes pigmentos apresentam potencial para eliminar cerca de 75% dos radicais ânion superóxido (Canadanovic-Brunet et al., 2011). As betalaínas estão também correlacionadas à inibição da clivagem de DNA, apresentando efeito protetor, diminuindo assim os danos causados pelo peróxido de hidrogênio no ácido nucléico (Sakihama et al., 2012). Além disso, são conhecidas também as propriedades de inibição à peroxidação lipídica e à decomposição heme, e ainda a neutralização de lipoperoxidases que podem danificar as células gastrointestinais durante a digestão (Kanner et al., 2001; Cai et al., 2003). Estes pigmentos podem modular o desiquilíbrio intrínseco entre as espécies oxidantes e o sistema de defesa antioxidante, criando um ambiente celular favorável para neutralizar o estresse oxidativo (Esatbeyoglu et al., 2014).
Principais fatores que afetam a qualidade de beterraba minimamente processada
O teor do pigmento e a sua conservação, são os principais quesitos que envolvem a manutenção e os vários fatores relacionados à qualidade da beterraba minimamente processada. Estes fatores estão ligados desde à estabilidade do pigmento, passando pelos aspectos visuais, até a qualidade nutricional e segurança do PMP. O processamento ocasiona perdas pontuais em betacianina e betaxantina. Partindo do material fresco contendo o máximo de pigmentos, o descascamento reduz a concentração de betacianinas e betaxantinas para 99,4% e 82,9%, respectivamente. Com a trituração/processamento o conteúdo destes pigmentos é reduzido para 91,6% e 67,5%, concomitantemente. O armazenamento do produto inteiro durante 20 dias, mesmo sob refrigeração de 5°C, acarreta em 53,1% e 63,6% de perdas de betacianinas e betaxantinas, respectivamente (Patkai et al., 1997).
Alguns elementos são preponderantes para a manutenção e estabilidade das betalaínas, além de garantirem seu total potencial anti- radicalar. Os principais fatores que governam positivamente a estabilidade das betalaínas são o alto grau de glicosilação, alta concentração do pigmento, alto grau de acilação, baixa atividade de água, constituintes da matriz, faixa de pH entre 3 e 7, presença de antioxidantes, assim como agentes quelantes, baixa temperatura, escuro e atmosfera de nitrogênio. Algumas condições que desfavorecem a estabilidade do pigmento são a presença de enzimas degradantes (PPO, POD, β-Glicosidases), metais catiônicos, O2 e H2O2 (Herbach et al. 2006a).
Ao produzir um alimento minimamente processado lidamos com todos estes fatores negativos decorrentes do procedimento e armazenamento. Como resposta, alterações no metabolismo das hortaliças são observadas, tal quais aumento da respiração, produção de etileno, desidratação gradativa, formação de metabólitos secundários, escurecimento enzimático e oxidação lipídica. Com a maior exposição dos tecidos, também ocorre produção de compostos voláteis e proliferação de microrganismos, o que reduz a vida útil desses produtos (Kluge et al., 2006). Uma vez que, que esta técnica promove lesões ao tecido vegetal é considerada uma forma de estresse para a planta (Kluge et al., 2005). Portanto, o entendimento dos fatores que governam as perdas ajuda a minimizá-las.
De forma geral, as betalaínas são influenciadas direta e indiretamente pelas mudanças no metabolismo da hortaliça. O estresse oxidativo decorrente dos danos ao tecido vegetal direciona às reações catabólicas do tecido injuriado e ao longo do tempo atinge as outras camadas de tecido pela reação em cadeia do processo. Beterrabas vermelhas apresentam várias enzimas endógenas, assim como peroxidases, β-glucosidades e polifenoloxidaes. A ação destas enzimas está relacionada à descompartimentalização celular e/ou ao estresse sofrido em razão do processamento e fabricação do alimento (Herbach et al., 2007). Suas atividades aceleram os processos de degradação de betalaínas e, consequentemente, proporciona perda de coloração. Esta perda chega a 30% após o processamento do produto, uma vez que a maior atividade enzimática de PPO e POD está situada na casca e assim, com a sua remoção, estas enzimas são expostas prejudicando tanto as betacianinas quanto as betaxantinas (Kapadia e Rao, 2013).
A ação da POD ocorre na presença de peróxido de hidrogênio (H2O2) e afeta principalmente as betacianinas por serem mais suscetíveis à enzima quando comparada às betaxantinas, que por sua vez, são oxidadas por peróxido de hidrogênio (Martinez-Parra e Muñoz, 2001; Terefe et al., 2014). Desta forma, quando a enzima catalase apresenta alta atividade a degradação das betaxantinas é praticamente inibida. Portanto, ao inibir a POD, consequentemente, espera-se o aumento da degradação das betaxantinas, pelo acúmulo de peróxido de hidrogênio (Wasserman et al., 1984). Mesmo as betalaínas mais estáveis estão sujeitas à oxidação pela POD, ou seja, a glicosilação da betanina não a protege totalmente da ação enzimática, uma vez que há um grupo hidroxila livre, promovendo a posterior hidrólise da molécula (Martinez-Parra e Muñoz, 1997), produção de produtos desidrogenados e descarboxilados ou, ainda, compostos betanidina-quinona (Martinez-Parra e Muñoz, 2001; Wybraniec e Michalowski, 2011).
A enzima PPO possui o elemento cobre como grupo prostético e catalisa a hidroxilação e a oxidação. Está associada, principalmente, à produção de ROS, induzidas por fatores de estresse, que agem diretamente sobre o metabolismo de lipídeos e compostos fenólicos (Zhang et al., 2010). Esta enzima utiliza compostos fenólicos e oxigênio molecular como substratos, sendo que uma das principais consequências disso é o escurecimento do tecido pela formação de produtos amarronzados (Sánchez-Ferrer et al., 1995; Chen et al., 2011). No caso do escurecimento, o substrato ο-difenol reage com o oxigênio formando ο-quinonas, que polimerizam resultando em melaninas escuras (Yoruk e Marshall, 2003). Acredita-se que a PPO seja um promotor da atividade da POD, uma vez que H2O2 é gerado como subproduto durante a oxidação dos substratos fenólicos (Tomas-Barberan e Spin, 2001) e a atividade da POD tem aumento progressivo ao longo do armazenamento de frutas e hortaliças (Lin et al., 2016).
As ROS, além de interferirem na conservação de beterraba minimamente processada por meio da ativação do sistema enzimático, também agem diretamente sobre as betalaínas. Estes pigmentos reagem com o oxigênio molecular por meio das hidroxilas em um processo oxido-redutor. Assim, produtos mantidos a nívei baixos de oxigênio, preferencialmente menores que os níveis da atmosfera do ar, favorecem tanto a manutenção dos pigmentos quanto garantem a reversibilidade da reação de degradação (von Elbe et al., 1974; Huang e von Elbe, 1987). A atividade de água afeta a estabilidade das betalaínas, reduzindo a mobilidade dos reagentes ou limitando a solubilidade de O2 (Delgado-Vargas et al., 2000). A redução da atividade de água melhora a estabilidade das betaninas, (Kearsley e Katsaboxakis, 1980), sendo que sua degradação é linear em relação ao aumento das taxas de atividade de água. Além disso, foi observado que a concentração do pigmento nos alimentos é proporcional a sua estabilidade, ou seja, quanto mais alto o teor de betalaínas mais estável é a molécula (Mohammer et al., 2005; Castellar et al., 2006) Os PMPs, geralmente, são armazenados sob atmosfera modificada, o que negligencia o efeito direto da luz. Sendo assim, a degradação dos pigmentos pela luz é dependente de oxigênio (Attoe e von Elbe, 1981; Huang e von Elbe, 1986). A luz excita os elétrons do cromóforo das betalaínas, elevando seu nível energético. Com isso, a reatividade da molécula aumenta ou a energia de ativação da molécula diminui (Jackman e Smith, 1996).
O pH é um fator chave para manutenção da cor do PMP, favorecendo tanto a estabilidade das betalaínas, em uma faixa de pH ótimo entre 5,0 e 6,0, quanto aumentando a eficiência da atividade enzimática, na faixa em torno de pH 3,0 a pH 4,0 (Shih e Wiley, 1981). As betalaínas, por serem ionizáveis em meio ácido, sofrem alterações de cor, principalmente em pH abaixo de 3,5, porém elas não se hidrolisam. A ampla faixa de pH que em que as betalaínas apresentam estabilidade, está entre 3,0 e 7,0 (Stintzing e Carle, 2004). Excedendo estes extremos, a sua degradação é prontamente induzida (von Elbe et al., 1974; Havlikova et al., 1983). Alguns fatores podem determinar a faixa de pH onde as betalaínas são mais estáveis, como por exemplo, temperaturas elevadas, que transferem sua estabilidade para pH 6 (Havlikova et al., 1983), assim como a presença de oxigênio, onde principalmente a betanina apresenta maior estabilidade entre pH 5,5 e 5,8. Já em condições anaeróbicas a molécula é mais estável na faixa de pH entre 4,0 e 5,0 (Huang e von Elbe, 1987). Betacianinas e betaxantinas apresentam divergência quanto à estabilidade, sendo que betaxantinas compreendem uma faixa de pH mais ampla de estabilidade, entre 4,0 e 7,0 (Cai et al., 2001). Equivalendo ao pH 5,5 como o mais estável para ambos as classes de betalaínas (Savolainen e Kuusi, 1978).
No entanto, o principal problema que limita a comercialização de beterraba minimamente processada é a perda de coloração superficial, caracterizada pelo esbranquiçamento ou “white blush”. Esse problema está associado com a forte desidratação das células superficiais danificadas pelo corte (Barry-Ryan e O’Beirne, 2000; Tatsumi et al., 1993; Vitti et al., 2005; Simões et al., 2010). O esbranquiçamento de beterraba minimamente processada pode ser observado já nos primeiros dias de armazenamento, limitando a vida útil do produto (Kluge et al., 2005). A intensidade do esbranquiçamento está associada ao tamanho do corte do produto, sendo que, quanto menor a espessura, mais acentuado o sintoma. Ainda, tem-se relacionado perda de betalaínas, como fator preponderante à aceleração do esbranquiçamento de beterrabas minimamente processadas, depreciando visualmente o produto (Kluge et al., 2006).
Estratégias de preservação de betalaínas em beterraba minimamente processada
As técnicas pós-colheita para minimizar as perdas são baseadas em tecnologias tradicionais como congelamento, refrigeração, atmosfera modificada, desidratação e conservas. No entanto, com a crescente demanda do mercado por PMPs que possibilitam ao consumidor, além da economia de tempo, a redução de resíduos, maior praticidade de consumo e facilidade no preparo de hortaliças (Kluge et al., 2008; Latorre et al., 2010). Técnicas emergentes de aplicação incipiente estão sendo visadas, como aplicação de radiação gama, micro-ondas, pulsos elétricos, altas pressões e pulsos de luz (Geveke e Brunkhorst, 2003; Tewari e Juneja, 2007). Estes avanços são importantes para atender a demanda do nicho de mercado atual que busca aliar melhorias na qualidade nutricional das refeições com a conveniência dos produtos (Latorre et al., 2012; Gomes et al., 2014).
A cadeia de frio faz parte do processo de fabricação dos PMPs desde logo após a colheita até a comercialização do produto. Durante o processamento a temperatura deve estar entre 10° C a 15° C, sendo um dos percalços da técnica. A temperatura ideal de armazenamento deve menor que 10ºC, sendo este considerado o nível aceitável para retardar com eficiência a proliferação de microrganismos. Em beterrabas minimamente processadas temperaturas entre 0º C e 5º C são as ideais para armazenamento de até 10 dias (Kujala et al., 2000; Vitti et al., 2005).
A atmosfera modificada é parte integrante da cadeia de processamento mínimo. Com a redução dos teores de oxigênio e aumento nos teores de gás carbônico, alcançados pela atmosfera modificada, pode-se prolongar a vida dos PMPs, devido à redução no metabolismo da hortaliça e atraso no desenvolvimento de microrganismos deteriorantes e patogênicos. (Leon, 1999; Martin-Diana et al., 2007; Silva, 2011).
Os filmes mais utilizados em PMPs são: cloreto de polivinila (PVC), polipropileno (PP), acetato de vinila (EVA), poliestireno (PS), polietileno (PE) e poliolefinas. Esses polímeros possuem boa permeabilidade, barreira ao vapor de água, proteção térmica, densidade uniforme, resistência, transparência, clareza, podem ser selados a quente e são recicláveis (Silveira e Escalona, 2014). A permeabilidade dos gases através dos filmes plásticos varia de acordo com a temperatura e espessura, de modo que a atmosfera de equilíbrio desejada ocorre exclusivamente em determinada faixa de temperatura, onde temperaturas altas promovem a dilatação do polímero e baixas temperaturas (abaixo de 10° C) reduzem a sua porosidade. Com o decorrer do tempo, o equilíbrio atmosférico é alcançado, em que o CO2 produzido pela respiração da hortaliça é liberado para o ambiente e o oxigênio presente na atmosfera externa é permeado para o interior da embalagem, a fim de compensar a quantidade consumida na respiração (Silva, 2011).
As atmosferas consideradas ideais para beterraba são 5% para ambos os gases O2 e CO2 a temperatura de 0 a 5°C (Silva, 2011). Com a redução do nível de oxigênio a atividade da PPO é significativamente reduzida e o gradativo aumento da concentração de CO2 age como inibidor (Martin-Diana et al., 2007; Silva, 2011). Assim, embalagens plásticas à vácuo representam uma boa estratégia para alcançar as concentrações de gases ideais para beterraba. Uma vez que, diminuem drasticamente as concentrações de oxigênio favorecendo a estabilidade de betalaínas, pela diminuição da oxidação provocada pelo oxigênio e por permitir a recuperação parcial destes pigmentos nestas condições (von Elbe et al., 1981; Herbach et al., 2007). Ravichandran et al. (2013) constataram que estas concentrações favorecem a conservação dos pigmentos, sendo que o vácuo pode reduzir em 20% a perda de betacianinas e 12% a perda de betaxantinas. Além disso, a embalagem plástica permite a manutenção da umidade relativa, minimizando os efeitos do esbranquiçamento superficial (Vitti et al., 2004).
Uma estratégia interessante para reduzir as perdas ao longo do tempo de armazenamento e durante o processamento tem sido a utilização de aditivos aplicados nas etapas de elaboração dos PMPs. Estas substâncias, de forma geral, funcionam reduzindo as reações enzimáticas, que promovem a oxidação de compostos na célula (Rababah et al., 2011). Agentes aditivos podem ser facilmente empregados, cada composto apresenta uma forma particular de ação. Como fontes de natureza quelantes temos o ácido cítrico e o EDTA (ácido etilenodiamino tetra-acético), ambos responsáveis por estabilizar moléculas de betanina protegendo-as da degradação catalisada por metais (Savolainen e Kuusi, 1978; Pasch e von Elbe, 1979; Attoe e von Elbe, 1984; Han et al., 1998; Herbach et al, 2006a; Herbach, 2007). A efetividade do ácido cítrico foi constata por Kluge et al. (2008), onde doses crescentes (até 2000 mg L-1) apresentaram proporcional manutenção da concentração de betalaínas em beterraba minimamente processada.
O ácido ascórbico também é um importante aditivo natural com atividade antioxidante que melhora a estabilidade dos pigmentos, porém atenção deve ser dada à concentração utilizada. Altas concentrações (>1000 mg kg-1) diminuem o tempo de meia-vida de betanina. Isso ocorre devido ao branqueamento causado pelo peróxido de hidrogênio durante a degradação do ácido ascórbico (Savolainen e Kuusi, 1978; Pasch e von e Elbe, 1979). Mantendo-se a faixa entre 0,1 a 1,0%, o ácido ascórbico se mostrou mais eficiente que o ácido isoascórbico na conservação de betalaínas. Além disso, o ácido ascórbico apresentou efeito tanto aplicado antes do processamento do alimento quanto após, agindo assim na prevenção e regeneração de betalaínas (Herbach et al., 2006b).
Além da aplicação de aditivos químicos, há técnicas que utilizam tratamento térmico, como o branqueamento e microndas. Estas técnicas se baseiam na desativação das enzimas oxidativas (β-glicosidase, PPO e POD) (Escribano et al., 2002). Porém, igualmente submetem o alimento à degradação parcial de seus pigmentos ao longo do tempo de exposição (Jiratanan e Liu, 2004; Herbach et al., 2006a; Ravichandran et al., 2013). A extensão das perdas pode chegar a 51% para betacianinas e 33% para betaxantinas, em ebulição por três minutos (Ravichandran et al., 2013). Este processo de degradação pode ocorrer pela isomerização, descarboxilação, clivagem por tempo de exposição a altas temperaturas ou, ainda, por ácidos presentes no meio celular (Herbach et al., 2004). No entanto, ao que parece, a utilização de micro- ondas favorece o aumento das betaxantinas e está correlacionada à potência da irradiação aplicada, que promove acréscimo de 7% na concentração de betalaínas, quando submetidas a 900 W e aumento de 19 % quando submetidas a 1800 W, ambos durante 30 segundos (Ravichandran et al., 2013).
Outras técnicas emergentes não-térmicas e não-químicas estão sendo estudadas para melhorar a conservação de beterraba minimamente processada. A irradiação dos alimentos é um processo seguro com efeitos mínimos sobre o alimento em uma dose de até 7,5 kGy (Latorre et al., 2010), com alta eficácia para eliminar microrganismos, uma vez que as micro-ondas penetram até as primeiras camadas celulares (Prakash et al., 2000; Waje et al., 2009; Latorre et al., 2010). Latorre et al. (2010) estudaram a influência da radiação gama (1 e 2 kGy) e puderam concluir que a betacianina é mais sensível à degradação pelo tratamento, devido a sua maior capacidade de retirar elétrons. No entanto, a perda dos pigmentos não foi suficiente para causar mudanças visuais significativas no produto.
Agradecimentos
Os autores agradecem a Rede Hortyfresco (http://www.hortyfresco.cl) pelo apoio técnico dedicado a esta publicação.
Referências
Amnah, M. A. A. (2013) Nutritional, Sensory and Biological Study of Biscuits Fortified With Red Beet Roots. Life Science Journal, 10:1579-1584.
Appezatto-Da-Glória, B. (2015) Morfologia de sistemas subterrâneos de plantas. Belo Horizonte: Editora 3i. 159p.
Attoe E.L.; von Elbe, J.H. (1981) Photochemical degradation of betanine and selected anthocyanins. J Food Sci, 46:1934–1937.
Attoe, E.L.; von Elbe, J.H. (1984). Oxygen involvement in betanin degradation. Z Lebensm Unters Forsch,179:232–236.
Azeredo, H.M.C. (2009) Betalains: properties, sources, applications, and stability–a review. Int. J. Food Sci. Technol. 44:2365–2376.
Barry-Ryan, C.; Martin-Diana, A.; Rico, D.; Barat, J. (2007) Extending and measuring the quality of fresh-cut fruit and vegetables: a review. Trends in Food Science & Technology, 18:373-386
Barry-Ryan, C.; O’Beirne, D. (2000) Effects of peeling methods on the quality of ready-to- use carrot slices. 2000. International Journal of Food Science and Technology, 35:243-254.
Bobbio, P.A.; Bobbio, F.O. (1984) Química do processamento de alimentos. Campinas: Fundação Cargill, 232p.
Borkowski, T.; Szymusiak, H.; Gliszczynska-Swiglo, A.; Rietjens, I.M.C.M.; Tyrakowska, B. (2005) Radical-scavenging capacity of wine anthocyanins is strongly pH- dependent. Journal of Agricultural and Food Chemistry, 53:5526-5534.
Brockington, S.F.; Walker, R.H.; Glover, B.J.; Soltis, P.S.; Soltis, D.E. (2011) Complex pigment evolution in the Caryophyllales. New Phytol, 190:854–864.
Cai, Y.; Corke, H. (2001) Effect of postharvest treatment on Amaranthus betacyanin degradation evaluated by visible/near-infrared spectroscopy. Journal Food Sci 66:1112–1118.
Cai, Y.; Sun, M.; Corke, H. (2003) Antioxidant activity of betalains from plants of the Amaranthaceae. J Agric Food Chem 51:2288–2294.
Canadanovic-Brunet, J.M.; Savatovic, S.S.; Cetkovic, G.S.; Vulic, J.J.; Djilas, S.M.; Markov, S.L. (2011) Antioxidant and antimicrobial activities of beet root pomace extracts. Czech Journal of Food Science, 29:575-585.
Cardoso-Ugarte, G. A.; Sosa-Morales, M. E.; Ballard, T.; Liceaga, A.; San Martín-González, M. F. (2014) Microwave-assisted extraction of betalains from red beet (Beta vulgaris). LWT - Food Science and Technology, 59:276-282.
Castellar, M.R.; Obón, J.M.; Fernández-López, J.A. (2006). The isolation and properties of a concentrated red-purple betacyanin food colourant from Opuntia stricta fruits. Journal of the Science of Food and Agriculture, 86:122-128.
Chen, Y. H.; Lin, H. T.; Lin, Y. F.; Zhao, Y. F.; Zhang, J. N. (2011) Effects of Phomopsis longanae Chi infection on lipoxygenase activity and fatty acid constituents of membrane lipids in pericarp of harvested longan fruits. J. of Tropical and Subtropical Botany, 19:260–266.
Chitarra, M. I. F.; Chitarra, A. B. (2005) Pós-colheita de frutas e hortaliças: fisiologia e manuseio. 2ª ed. Revisão ampliada. Lavras: Universidade Federal de Lavras.
Delgado-Vargas, F., Jiménez, A. R., & Paredes-López, O. (2000) Natural pigments: Carotenoids, anthocyanins, and betalains— characteristics, biosynthesis, processing, and stability. Critical Reviews in Food Science and Nutrition, 40:173–289.
Esatbeyoglu, T.; Wagner, A. E.; Motafakkerazad, R.; Nakajima, Y.; Matsugo, S.; Rimbach, R. (2014) Free radical scavenging and antioxidant activity of betanin: electron spin resonance spectroscopy studies and studies in cultured cells. Food Chemistry and Toxicology, 73:119-126.
Escribano J.; Pedreno M.A.; Garcia-Carmona F.; Munoz, R. (1998) Characterization of the antiradical activity of betalains from Beta vulgaris L. roots. Phytochemical Analysis, 9:124-127.
Escribano, J.; Gandía-Herrero, F.; Caballero, N.; Pedren, M.A. (2002) Subcellular Localization and Isoenzyme Pattern of Peroxidase and Polyphenol Oxidase in Beet Root (Beta vulgaris L.). J. of Agriculture and Food Chemistry, 50: 6129-6163.
Gandía-Herrero F.; Jiménez-Atiénzar, M.; Cabanes, J.; Escribano, J.; García-Carmona, F. (2009) Fluorescence detection of tyrosinase activity on dopamine-betaxanthin purified from Portulaca oleracea (common purslane) flowers. J Agric Food Chem, 57:2523-2528.
Gandia-Herrero, F.; Escribano, J.; García-Carmona, F. (2010) Structural implications on color, fluorescence, and antiradical activity in betalains. Planta, 232:449–460.
Gandia-Herrero, F.; Garcia-Carmona, F. (2013) Biosynthesis of betalains: yellow and violet pigments. Trends Plant Sci. 18:334-343.
Gandía-Herrero, F.; García-Carmona, F.; Escribano, J. (2005) Floral fluorescence effect. Nature, 437:334-334.
García-Barrera, F.A.; Reynoso, C.R.; Gonzalez de Mejía, E. (1998) Estabilidad de las betalaínas extraídas del garambullo (Myrtillocactus geometrizans). Food Science and Technology International, 4:115–120.
Gasztonyi, M.N., H. Daood, M.T. Hajos, and P. Biacs. (2001) Composition of red beet (Beta vulgaris var. Conditiva) varieties on the basis of their pigment components. Journal of the Science of Food and Agriculture, 81:932–933.
Gengatharan, A.; Dykes, G. A.; Choo, W. S. (2015) Betalains: Natural plant pigments with potential application in functional foods. LWT - Food Science and Technology, 64:645-649.
Geveke, D.J.; Brunkhorst C. (2003) Inactivation of Saccharomyces cerevisiae with radio frequency electric fields. Journal Food Prot., 66:1712-1715.
Gliszczynska-Swiglo, A.; Szymusiak, H.; Malinowska, P. (2006) Betanin, the main pigment of red beet: Molecular origin of its exceptionally high free radical-scavenging activity. Food Additives and Contaminants, 11:1079–1087.
Gomes, H. M.; Vieira, T.; Fundo, J. F.; Almeida, D. P. F. (2014) Polyphenoloxidase activity and browning in fresh-cut ‘Rocha’ pear as affected by pH, phenolic substrates, and antibrowning additives. Postharvest Biology and Technology, 91:32-38.
Han, D.; Kim, S.J.; Kim, S.H.; Kim, D.M. (1998) Repeated regeneration of degraded red beet juice pigments in the presence of antioxidants. J Food Sci, 63:69–72.
Havlikova, L.; Mikova, K.; Kyzlink, V. (1983) Heat stability of betacyanins. Zeitschrift für Lebensmittel-Untersuchung und – Forschung, 177:247–250.
Herbach K.M.; Maier C, Stintzing FC, Carle R. (2007) Effects of processing and storage on juice color and betacyanin stability of purple pitaya (Hylocereus polyrhizus) juice. Eur Food Res Technol, 224: 649–658.
Herbach K.M.; Stintzing, F.C.; Carle, R. (2006a) Stability and color changes of thermally treated betanin, phyllocactin, and hylocerenin solutions. J Agric Food Chem, 54: 390–398.
Herbach, K.; Stintzing, F.; Carle, R. (2004) Impact of thermal treatment on colour and pigment pattern of red beet (Beta vulgaris L.) preparations. J. Food Sci, 69:491–498.
Herbach, K.M;, Rohe, M.; Stintzing, F.C; Carle, R. (2006b) Structuraland chromatic stability of purple pitaya (Hylocereus polyrhizus [Weber] Britton & Rose) betacyanins as affected by the juice matrix and selected additives. Food Res Int, 39:667–677.
Heuer, S.; Richter, S.; Metzger, J.W.; Wray, V.; Nimtz, M.; Strack, D. (1994) Betacyanins from bracts of Bougainvillea glabra. Phytochemistry, 37:761–767.
Huang, A.S.; von Elbe, J.H. (1986) Stability comparison of two betacyanine pigments — Amaranthine and betanine. J Food Sci, 51:670–674.
Huang, A.S.; von Elbe, J.H. (1987) Effect of pH on the degradation and regeneration of betanine. J Food Sci, 52:1689–1693.
Jackman, R.L.; Smith, J.L. (1996). Anthocyanins and betalains. In: Hendry CF, Houghton JD, editor. Natural food colorants. London: Blackie Academic & Professional. p 244–309.
Jiratanan, T.; Liu, R.H. (2004) Antioxidant activity of processed table beets (Beta vulgaris var, conditiva) and green beans (Phaseolus vulgaris L.). J. Agric. Food Chem, 52:2659–2670.
Kanner, J., Harel, S., Granit, R., (2001) Betalains. A new class of dietary cationized antioxidants. J. Agric. Food Chem, 49:5178–5185.
Kapadia e Rao. (2013). Anticancer effects of red beet pigments. In Red beet biotechnology – Food and pharmaceutical applications. 125-154.
Kearsley, M.W.; Katsaboxakis, K.Z. (1980) Stability and use of natural colours in foods. J Food Technol, 15:501–514.
Kluge, R.A.; Costa, C.A.; Vitti, M.C.D.; Ongarelli, M.G.; Gallo, L.A.; Melo, M.; Moretti, M. (2005) Avaliação de diferentes tipos de descascamento em beterraba minimamente processada. Revista Iberoamericana de Tecnología Postcosecha, 7:48-55.
Kluge, R.A.; Costa, C.A.; Vitti, M.C.D.; Ongarelli, M.G.; Jacomino, A.P.; Moretti, C.L. (2006) Armazenamento refrigerado de beterraba minimamente processada em diferentes tipos de corte. Ciência Rural, 36:263-270.
Kluge, R.A.; Picoli, A.A.; Aguila, J.S. (2010) Respiração e produção de etileno em beterrabas inteiras e minimamente processadas submetidas a tratamentos com etileno e biorreguladores. Horticultura Brasileira, 28: 54-57.
Kluge, R.A.; Vitti, M.C.D.; Sasaki, F.F.; Jacomino, A.P.; Moretti, C.L. (2008) Respiratory activity and pigment metabolism in fresh-cut beet roots treated with citric acid. Horticultura Brasileira, 26:520-523.
Knuthsen, P. (1981) Investigations on beetroot colours for the purpose of regulation. Z. Lebensm. Unters. Forsch, 172:195–200.
Kujala, T.; Loponen, J.; Klika, K.; Pihlaja, K. (2000) Phenolics and betacyanins in red beetroot (Beta vulgaris) root: distribution and effect of cold storage on the content of total phenolics and three individual compounds. J. Agric. Food Chem, 48:5338–5342.
Kujala, T.; Loponen, J.; Pihlaja, K. (2001) Betalains and phenolics in red beetroot (Beta vulgaris) peel extracts: extraction and charactrization. Zeitschrift für Naturforschung C., 56:343–348.
Kujala, T.S.; Vienola, M.S.; Klika, K.D.; Loponen, J.M.; Pihlaja, K. (2002) Betalain and phenolic composition of four beetroot (Beta vulgaris) cultivars. European Food Research and Technology, 214:505–510.
Latorre, E.; Bonelli, P.R.; Rojas, A.; Gerschenson, L. (2012) Microwave inactivation of red beet (Beta vulgaris L. var. conditiva) peroxidase and polyphenoloxidase and the effect of radiation on vegetable tissue quality. Jornal of Food Engineering, 109:676-668.
Latorre, M.E.; Narvaiz, P.; Rojas, A.M.; Gerscenson, L.N. (2010) Effects of gamma irradiation on bio-chemical and physico- chemical parameters of fresh-cut red beet (Beta vulgaris L. var. conditiva) root. Journal of Food Engineering, 98:178–191.
Lee, C.Y.; Smith, N.L. (1979) Blanching effect on polyphenol oxidase activity in table beets. J Food Sci, 44:82–86.
Leon, G. (1999) Modified-atmosphere packaging of produce. In: RAHMAN, S. Handbook of food preservation. 315-334.
Lin, Y.; Lin, H.; Lin, Y.; Zhang, S.; Chen, Y.; Jiang, X. (2016) The roles of metabolism of membrane lipids and phenolics in hydrogen peroxide-induced pericarp browning of harvested longan fruit. Postharvest Biology and Technology, 111:53–61.
Martin-Diana, A. B.; Rico, D.; Henehan, G.; Frias, J. M.; Barat, J. (2007) Extending and Measuring the Quality of Fresh-Cut Fruit and Vegetables: a Review. Trends in Food Technology, 18:373-386.
Martinez-Parra, J.; Muñoz, R. (1997) An approach to the characterization of betanine oxidation catalyzed by horseradish peroxidase. J. Agric. Food Chem., 45:2984–2988
Martinez-Parra, J.; Muñoz, R. (2001) Characterization of betacyanin oxidation catalyzed by a peroxidase from Beta vulgaris L. roots. J. Agric. Food Chem, 49:4064–4068.
Minale, L.; Piattelli, M.; de Stefano S.; Nicolaus, R.A. (1966) Pigments of Centrospermae VI. Acylated betacyanins. Phytochemistry 5:1037–1052.
Mohammer, M.R.; Stintzing, F.C.; Carle, R. (2005) Development of a process for the production of a betalain-based colouring foodstuff from cactus pear. Innov Food Sci Emerg Tech, 6:221–231.
Moreno, D.A.; Garcia-Viguera, C.; Gil, J. I.; Gil-Izquierdo, A. (2008) Betalains in the era of global agri-food science, technology and nutritional health. Phytochem, 7:261–280.
Nilsson, T. Studies into the pigments in beetroot (Beta vulgaris L. vulgaris var. rubra L.). (1970) Lantbruksho¨gskolans Annaler, 36:179-219.
Osornio, M.M.L.; Chaves, A.R. (1998) Quality changes in stored raw grated beetroots as affected by temperature and packaging film. Journal of Food Science, 63:327-330.
Pasch, J.H.; von Elbe, J.H. (1979) Betanine stability in buffered solutions containing organic acids, metal cations, antioxidants, or sequestrants. J Food Sci, 44:72–74.
Patkai, G.Y.; Bara, J.; Varsanyi, I. (1997) Decomposition of anticarcinogen factors of the beetroot during juice and nectar production. Cancer Letters, 114:105–106.
Pedreño, M. A.; Escribano, J. (2000). Studying the oxidation and antiradical activity of betalain from beetroot. Journal of Biological Education, 35:49–59.
Pedreño, M.A.; Escribano, J. (2001) Correlation between antiradical activity and stability of betanine from Beta vulgaris L. roots under different pH, temperature and light conditions. J. Sci. Food Agric., 81:627–631.
Picoli, A.A.; Faria, D.B.; Jomori, M.L.L.; Kluge, R.A. (2010) Biorreguladores e o processamento mínimo de beterrabas. Bragantia, 69:983-988.
Prakash, A.; Guner, A.R.; Caporaso, F.; Foley, D.M. (2000) Effects of low-dose gamma irradiation on the shelf life and quality characteristics of cut romaine lettuce packaged under modified atmosphere. J. Food Sci., 65:549–553.
Rababah, T. M.; Mahasneh, M. A.; Kilani, I.; Yang, W.; Alhamad, M.; Ereifej, K.; Datt, M. A. (2011) Effect of jam processing and storage on total phenolics, antioxidant activity and anthocyanins of different fruits. Journal of the Science of Food and Agriculture, 91:1096–1102.
Ravichandran, K.; Thaw Saw, N.M.M.; Mohdaly, A.A.A.; Gabr, A.M.M.; Kastel, A.; Riedel, H.; Cai, Z.; Knorr, D.; Smetanska, I. (2013) Impact of processing of red beet on betalain contente and antioxidante activity. Food Res. Int., 20:670-675.
Reddy, K.M.; Ruby, L.; Lindo, A.; Nair, G.M. (2005). Relative inhibition of lipid peroxidation, ciclooxygenase enzymes and human tumor cells prolifieration by natural food color. Journal of Agricultural and Food Chemistry, 53:9268–9273.
Reynoso, R.; Garcia, F.A.; Morales, D.; Gonzáles de Mejía, E. (1997) Stability of betalain pigments from a Cactacea fruit. J Agric Food Chem, 45:2884–2889
Roberts, M.F.; Strack, D.; Wink, M. (2010) Biosynthesis of alkaloids and betalains. In Annual plant reviews, Biochemistry of plant secondary metabolites, 40:20–91.
Sakihama, Y.; Maeda, M.; Hashimoto, M.; Tahara, S.; Hashidoko, Y. (2012) Beetroot betalain inhibits peroxynitrite-mediated tyrosine nitration and DNA strand cleavage. Free Radical Research, 46:93-99.
Sánchez-Ferrer, A., Rodríguez-López, J.N., García-Cánovas, F., García-Carmona, F. (1995) Tyrosinase: a comprehensive review of its mechanism. Biochim. Biophys. Acta, 1247:1–11.
Sapers, G.M.; Hornstein, J.S. (1979) Varietal differences in colorant properties and stability of red beet pigments. Journal of Food Science, 44:1245–1248.
Savolainen K.; Kuusi T. (1978) The stability properties of golden beet and red beet pigments: influence of pH, temperature, and some stabilizers. Z Lebensm Unters Forsch, 166:19–22.
Schliemann, W.; Steiner, U.; Strack, D. (1998) Betanidin formation from dihydroxyphenylalanine in a model assay system. Phytochemistry, 49:1593–1598.
Shih, C.C.; Wiley, R.C. (1981) Betacyanine and betaxanthine decolorizing enzymes in the beet (Beta vulgaris L.) root. J Food Sci, 47:164–172.
Shimada, S.; Otsuki, H.; Sakuta, M. (2007) Transcriptional control of anthocyanin biosynthetic genes in the Caryophyllales. J. Exp. Bot, 58:957–967.
Silva, E.O. Processamento Mínimo de Produtos Hortifrutícolas. (2011) Fortaleza: EMBRAPA. 61 p.
Silveira, A.C.; Escalona, V.H. (2014) The use of physical treatments on fresh-cut produce. Stewart Postharvest Review, 3:2–6.
Simões, A.N.; Ventarella, M.C.; Moretti, C.L.; Carnelossi, M.A.G.; Puschmann, R. (2010) Anatomical ad physiological evidence of White blush on baby carrot surfaces. Postharvest Biol. and technology, 55:45-52.
Singer, J.W.; von Elbe, J.H. (1980) Degradationrates of vulgaxanthine I. J Food Sci, 45:489–91.
Stintzing, F. C.; Carle, R. (2006) Cactus fruits - more than colour. Fruit Processing, 16: 166–171.
Stintzing, F.C.; (2002) Betacyanins in fruits from red-purple pitaya, Hylocereus polyrhizus (Weber) Britton & Rose. Food Chem, 77:101–106.
Stintzing, F.C.; Carle R. (2004) Functional properties of anthocyanins and betalains in plants, food, and in human nutrition. Trends Food Sci Technol, 15:19–38.
Stintzing, F.C.; Carle. R. (2008) Analysis of betalains. In Food colorants: Chemical and functional properties, ed. C. Socaciu, 507–520.
Strack, D.; Vogt, T.; Schliemann, W. (2003) Recent advances in betalain research. Phytochemistry, 62:247-269.
Tanaka, Y.; Sasaki, N.; Ohmiya, A. (2008) Biosynthesis of plant pigments: anthocyanins, betalains and carotenoids. The Plant Journal, 54:733–749.
Tatsumi, Y.; Watad, A.E.; Ling, P.P. (1993) Sodium cholorine treatment or waterjet slicing effects on White tissue development os carrot sticks. Journal of Food Science, 58:1390-1392.
Terefe, N. S.; Buckow, R.; Versteeg, C. (2014) Quality related enzymes in fruit and vegetable products: effects of novel food processing technologies, part 1: high pressure processing. Critical Reviews in Food Science and Nutrition, 54:24–63.
Tomas-Barberan, F.A.; Espin, J.C. (2001) Phenolic compounds and related enzymes as determinants of quality in fruits and vegetables. Journal of the Science of Food and Agriculture, 81:853–876.
Vitti, M.C.D. 2003. Aspectos fisiológicos, bioquímicos e microbiológicos em beterrabas minimamente processadas. Piracicaba: USP ESALQ. 116p (tese mestrado).
Vitti, M.C.D. Kluge, R.A.; Gallo, C.R.; Schiavinato, M.A.; Moretti, C.L.; Jacomino, A.P. (2004) Aspectos fisiológicos e microbiológicos de beterraba minimamente processada. Pesquisa Agropecuária Brasileira,.39:1027-1032.
Vitti, M.C.D.; Yamamoto, L.K.; Sasaki, F.F.; Aguila, J.S.; Kluge, R.A.; Jacomimo, A.P. (2005) Quality of minimally processed beet roots stored in diferente temperatures. Brazillian Archives of Biology and Technology, 48:503–510.
von Elbe, J.H.; Schwartz, S.J.; Hildenbrand, B.E. (1981) Loss and regeneration of betacyanin pigments during processing of red beets. J Food Sci, 46:1713–1715.
von Elbe, J.H.; Attoe, E.L. (1985) Oxygen involvement in betanine degradation — Measurement of active oxygen species and oxidation reduction potentials. Food Chem, 16:49–67.
von Elbe, J.H.; Maing, I.Y.; Amundson, C.H. (1974) Colour stability of betanin. J Food Sci, 39:334–7.
Waje, C.K.; Jun, S.Y.; Lee, Y.K.; Kim, B.N.; Han, D.H.; Jo, C.; Kwon, J.H. (2009) Microbial quality assessment and pathogen inactivation by electron beam and gamma irradiation of commercial seed sprouts. Food Control, 20:200–204.
Wasserman, B.P.; Guilfoy, M.P. (1984) Solubilization of the red beet cell wall betanin decolorizing enzyme. J Food Sci, 49:1075–1077.
Wink, M. (1997) Compartmentation of secondary metabolites and xenobiotics in plant vacuoles. Advances in Botanical Research, 25:41-169.
Wu, L. C.; Hsu, H. W.; Chen, Y.C.; Chiu, C. C.; Lin, Y. I.; Ho, J.A.A. (2006) Antioxidant and antiproliferative activities of red pitaya. Food Chemistry. 95:319-327.
Wybraniec, S.; Michałowski, T. (2011) New pathways of betanidina and betanin enzymatic oxidation. J. Agric. Food Chem, 59:9612–9622.
Yoruk, R.; Marshall, M.R. (2003) Physicochemical properties and function of plant polyphenol oxidase: a review. Journal of Food Biochemestry, 27:361–422.
Zhang, C. F.; Ding, Z. S.; Xu, X. B.; Wang, Q.; Qin, G. Z.; Tian, S. P. (2010) Crucial roles of membrane integrity and relative proteins in enhancing tolerance of peach fruit to chilling injury. Amino Acid Journal, 39:181–194.
Autor notes
Autor de correspondencia. E-mail: rakluge@usp.br.