Revisión Bibliográfica
Fotocatálisis: inicio, actualidad y perspectivas a través del TiO2
Photocatalysis: beginning, present and trends through TiO2
Fotocatálisis: inicio, actualidad y perspectivas a través del TiO2
Avances en Química, vol. 12, núm. 2-3, pp. 45-59, 2017
Universidad de los Andes

Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial-CompartirIgual 3.0 Internacional.
Recepción: 23 Marzo 2017
Revisado: 09 Agosto 2017
Aprobación: 04 Diciembre 2017
Resumen: Esta revisión se enfoca en los conceptos básicos y fundamentos sobre los procesos fotocatalíticos, se consideró al TiO2 para describir los factores que determinan las reacciones fotocatalíticas. Se aborda el mecanismo de fotoexcitación de acuerdo con el modelo de bandas y se utiliza la termodinámica para establecer las diferencias entre la catálisis y la fotocatálisis. Se revisan y discuten las principales estrategias de síntesis y modificación del TiO2 que conllevan a una mayor eficiencia de las reacciones fotocatalíticas; se consideran además las aplicaciones de la fotocatálisis y su importancia en la remediación ambiental.
Palabras clave: dióxido de titanio (TiO2), fotocatálisis, modelo de bandas de un semiconductor, modificaciones de TiO2, síntesis de estructuras fotocatalíticas de TiO2.
Abstract: This review focuses on the fundamentals of photocatalysis. TiO2 was used to explain the performance of semiconductor photocatalysts under photoirradiation as well as the factors which determine the photocatalytic reactions. The band scheme was adopted to describe the photoexcitation mechanism of a photocatalyst, and the difference between catalysis and photocatalysis was clarified through the thermodynamics of both processes. Synthesis and modification approaches of TiO2 were listed. Finally, the application of TiO2photocatalysis was considered in the environmental remediation area.
Keywords: Band scheme of a semiconductor, Photocatalysis, TiO2 modification strategies, Titanium dioxide (TiO2), Synthesis of TiO2-based photocatalysts.
Introducción
La creciente contaminación ambiental, así como el acelerado consumo de combustibles fósiles ha ocasionado un fuerte impacto en la naturaleza lo que ha motivado a la comunidad científica a desarrollar tanto fuentes de energía limpia como alternativas químicamente verdes para la purificación de agua y aire, desinfección de agua, remediación de desechos peligrosos y tecnología auto-limpiante. De esta manera, la fotocatálisis heterogénea ha aparecido como un método “verde” y ambientalmente amigable que atiende los problemas emergentes mencionados1,2. Este proceso se caracteriza por un fotocatalizador particulado suspendido en una disolución o puesto en contacto con un sustrato (s) en fase gaseosa y bajo irradiación con energía suficiente para producir foto-excitación3. Las investigaciones en fotocatálisis incrementaron exponencialmente (figura 1) desde 1972 con el descubrimiento de la hidrólisis electroquímica fotoasistida del agua con un monocristal de TiO2 como electrodo de trabajo y un contraelectrodo de platino, bajo la aplicación de un potencial químico o electroquímico4.
El TiO2 es uno de los óxidos metálicos más estudiados por su actividad fotocatalítica y sus propiedades; es considerado no tóxico, resistente a la corrosión y biocompatible5,6. En presencia de radiación UV, las reacciones que suceden en su superficie permiten generar especies reactivas como electrones (e-) y huecos (h+), que a su vez son capaces de provocar reacciones de reducción y oxidación, respectivamente, en el medio circundante. Estos procesos pueden aprovecharse en remediación ambiental, generación de energías limpias, síntesis orgánica, etc.7,8,9,10. Sin embargo, la aplicación del TiO2 a escala industrial aún requiere incrementar la eficiencia de las reacciones fotocatalíticas en su superficie, las mismas que dependen de los mecanismos de transferencia a de masa, cargas e iones. Para ello, es imperativo ampliar la superficie específica del fotocatalizador, parámetro relacionado con la foto-actividad y nanomorfología del material11. Dada la importancia y el progreso de la fotocatálisis, se han reportado numerosos métodos de síntesis de nanopartículas de TiO2 con diferentes propiedades y características. Además, con la finalidad de aprovechar el espectro visible, se han desarrollado numerosas técnicas de modificación como la incorporación de especies dopantes, la formación de hetero-estructuras mediante el acoplamiento de óxidos semiconductores o metales nobles y la sensitización con colorantes12,13.
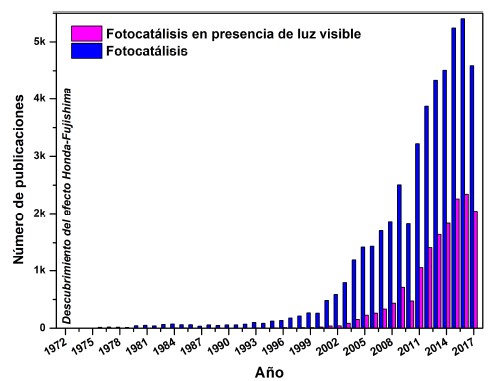
Fig. 1
Número de publicaciones en el ámbito de fotocatálisis y fotocatálisis en presencia de luz visible desde 1972 hasta la actualidad de acuerdo con la base de datos de Scopus
Este trabajo de revisión aborda inicialmente conceptos fundamentales de la actividad fotocatalítica (c catálisis vs. foto-catálisis), los parámetros determinantes de e las reacciones fotocatalíticas y su termodinámica. Posteriormente, la discusión se centra exclusivamente en el TiO2: sus características y propiedades, las estrategias de modificación para este semi-conductor, el efecto de la cristalinidad en la fotocatálisis, síntesis de diferentes estructuras con capacidad fotocatalítica para culminar con las aplicaciones ambientales en la descontaminación de agua, descontaminación de aire y descontaminación de suelo.
Actividad fotocatalítica: catálisis vs. fotocatálisis
La actividad fotocatalítica es la propiedad de un material sólido inducida por la irradiación de fotones con energía igual o superior a la energía de la banda prohibida (“band gap”) del material en su superficie, lo que provoca que los e- de la banda de valencia (BV) se exciten hacia la banda a de conducción (BC) y dejen huecos en la primera. De esta manera, se generen pares e--h+ llamados excitones, que posteriormente pueden aprovecharse para llevar a cabo reacciones redox14. El término “actividad” ha sido usado ampliamente por investigadores en los campos de fotocatálisis y catálisis, en la mayoría de los casos sin distinción entre “actividad fotocatalítica” y “actividad catalítica”. Por ello, se hace necesario aclarar la diferencia entre ambos términos. Por un lado, la actividad catalítica hace referencia al desempeño de un catalizador, donde cada sitio activo cuenta en la reacción y, por tanto, la velocidad de la reacción por sitio activo corresponde a la “actividad catalítica. Además, el número de recambio (“turnover number”o“turnover frequency”) indica el número de veces en que un sitio activo es capaz de generar producto (s) en la unidad de tiempo; por lo tanto, la velocidad de la reacción depende de la densidad de sitios activos (figura 2). Por otra parte, en un fotocatalizador no existen tales sitios activos con el mismo significad que en catálisis; en este caso, la velocidad de la reacción fotocatalítica depende de otros factores como de la intensidad de la luz incidente, así como de la velocidad de recombinación entre e- y h+15.
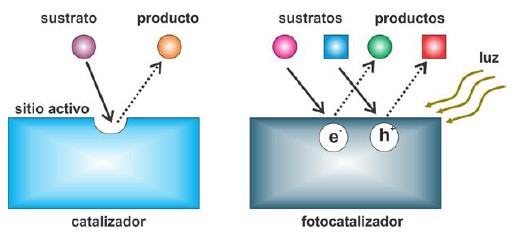
Fig. 2
Diferencia entre un material catalizador y un fotocatalizador con base en la presencia de sitios activos15
La principal diferencia entre catálisis y fotocatálisis es su termodinámica asociada. La catálisis posibilita acelerar reacciones espontáneas, con energía libre de Gibbs de reacción negativa (ΔG <0), mediante la disminución de la energía de activación. Contrariamente, la fotocatálisis hace posibles reacciones que requieren el suministro de energía (ΔG >0) tales como la hidrólisis del agua para generar hidrógeno y oxígeno16.
Estimaciones de la energía de activación aparente en reacciones fotocatalíticas a través de curvas de Arrhenius han reportado valores muy pequeños al compararlos con los de reacciones catalíticas. La Tabla 1 incluye los valores de energía de activación aparente para un conjunto de reacciones fotocatalíticas. Se habla de energía de activación aparente porque la energía de activación es proporcional a la energía libre de Gibbs de reacción global, dado que las reacciones fotocatalíticas proceden aun cuando ΔG > 0, su velocidad puede no estar controlada por la energía de activación. Adicionalmente, el mecanismo de las reacciones fotocatalíticas incluye la recombinación de e-y h+ así como las reacciones redox en las que participan estas especies y aunque se considere que los e-y h+ se encuentran activos, dicho estado es creado por energía luminosa y no por energía térmica, variable que se evalúa por medio de la temperatura de reacción17.
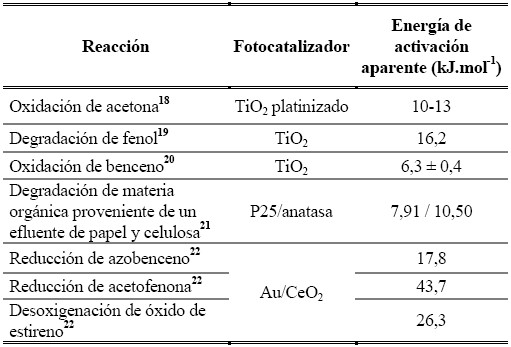
Ver notas 18, 19, 20, 21 y 22.
El TiO2: características, propiedades y efecto del tamaño y la estructura cristalina
El TiO2 es un óxido metálico abundante, cerca del 0,44% de la corteza terrestre corresponde a Ti y la producción mundial anual del óxido es de aproximadamente 4,3 millones ton23,24. En la naturaleza se lo puede encontrar en tres formas cristalográficas: rutilo, anatasa y brookita (figura 3). En condiciones ambientales, el rutilo constituye la fase más estable termodinámicamente; sin embargo, cuando el tamaño de partícula es 10-20 nm, la fase más estable es anatasa6,12.
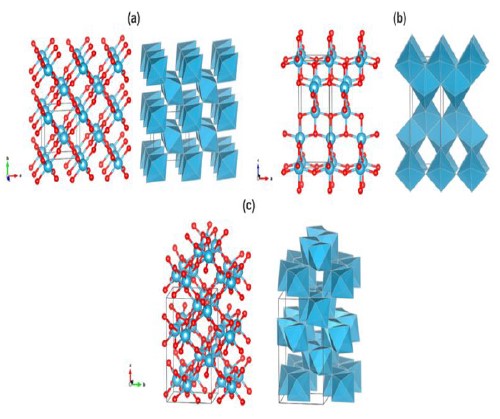
Fig. 3
Estructura cristalina de (a) rutilo, (b) anatasa y (c) brookita. Modelo de esferas y barras a la izquierda y modelo de poliedro a la derecha; en color rojo se representan los átomos de oxígeno y en azul los de titanio6
El TiO2 es altamente atractivo debido a su estabilidad química, alta fotoestabilidad, actividad fotocatalítica, no toxicidad y bajo costo; por ello, ha sido empleado en diversos productos, desde protectores solares hasta en dispositivos complejos como celdas fotovoltaicas. Sus aplicaciones incluyen la degradación fotocatalítica de contaminantes, purificación de agua, biosensores, distribución controlada de fármacos, entre otras25.
El TiO2 es un semiconductor tipo n cuyos defectos superficiales más comunes son vacantes de oxígeno que corresponden a electrones desapareados resultantes de haber sido transferidos desde un orbital 2p del oxígeno hacia la banda de conducción formada por orbitales 3d del Ti con la respectiva remoción del átomo de oxígeno. Es esta acumulación de electrones en la superficie del TiO2 la que determina sus propiedades químicas, pues todos los procesos que ocurren en la superficie de los semiconductores se llevan a cabo para alcanzar un equilibrio entre el potencial del nivel Fermi y el potencial químico de los adsorbatos26.
El “band gap” del TiO2 es de 3,2 eV y de 3,0 eV para las formas anatasa y rutilo respectivamente. Para vencer esta brecha energética y provocar la fotoexcitación, generación de pares e- - h+, es necesario incidir fotones del rango UV (λ ≤ 390 nm)27. Sin embargo, debe entenderse que dicha excitación no significa un desplazamiento espacial de los e- puesto que la BV y la BC son niveles energéticos mas no indican la posición de las especies fotogeneradas28. Por esto, la figura 4 muestra un esquema de bandas que describe de manera más clara un sistema fotocatalítico general. En el eje vertical se considera la energía, mientras que en el eje horizontal la dimensión de la partícula15.
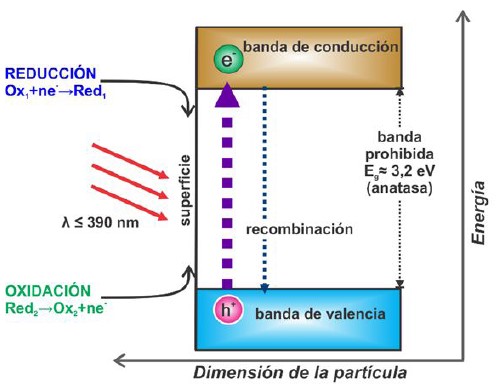
Fig. 4
Esquema del proceso fotocatalítico en la superficie de una partícula de un semiconductor bajo excitación luminosa30
Los h+ en la BV son fuertes agentes oxidantes y los e- en la BC actúan como reductores. Estos pares cargados pueden: i) recombinarse y disipar su energía en forma de radiación electromagnética o calor, o ii) migrar a la superficie del TiO2 para reaccionar con moléculas adsorbidas. Así, los e- pueden desplazarse, a través del bulk, hacia la superficie de la partícula, mediante trampas de electrones en la red cristalina las cuales pueden ser de dos tipos: superficiales y profundas. Esta profundidad considera la distancia de nivel de energía entre la base de la BC y las trampas de electrones. Las trampas superficiales son beneficiosas para el proceso de migración de los electrones a la superficie del fotocatalizador y por tanto favorecen la reacción; mientras que, las trampas más profundas constituyen centros de recombinación. Hasta la presente revisión, se dispone de poca información referente a la densidad y distribución espacial de las áreas de atrapado ya que su estructura no ha sido totalmente clarificada29.
Como ya se indicó anteriormente, no todos los pares e- - h+ participan efectivamente en reacciones redox sobre la superficie del TiO2, lo cual disminuye el rendimiento del proceso fotoinducido27. Generalmente, pueden darse mecanismos de atrapado, relajación y recombinación de los e y h+, los mismos que suceden en las mencionadas áreas de captura de carga (trampas), que se han considerado constituidas por defectos cristalinos o por impurezas del material. Es por ello que, muchos grupos de investigación han enfocado sus esfuerzos en mejorar los métodos de síntesis de nano-partículas y nanoestructuras, con la finalidad de disminuir los defectos cristalinos y por consiguiente, reducir la tendencia a la recombinación de las especies fotoactivas31. Pese a ello, es importante considerar que no es posible generalizar respecto a los parámetros morfológicos y estructurales que favorecen las reacciones fotocatalíticas. Tal es el caso del desempeño fotocatalítico de la fase anatasa que comúnmente se ha indicado mayor al de la fase rutilo32. Ohtani et al. 33 presentaron un análisis estadístico multivariable que consideró la interacción de seis propiedades físicas o estructurales de 35 muestras de TiO2 en cinco tipos de reacciones fotocatalíticas. Dichas variables fueron superficie específica (BET), densidad de defectos cristalinos, tamaño de partícula primario, tamaño de partícula secundario y la existencia de las fases rutilo o anatasa. Las reacciones que se evaluaron fueron desprendimiento de oxígeno junto con deposición de plata, deshidrogenación de metanol, descomposición de ácido acético, descomposición de acetaldehído y síntesis de ácido pipecolínico a partir de L-lisina. La correlación de actividades fotocatalíticas de estas reacciones con las respectivas propiedades, indicaron que cada propiedad física o estructural puede ser beneficiosa en ciertos casos, pero no en todos.
Energía libre de Gibbs y conversión energética
La fotocatálisis puede dar paso tanto a reacciones espontáneas (ΔG < 0) como no espontáneas (ΔG > 0) y sus requisitos se restringen a que el potencial redox de un sustrato para ser reducido (Pred) sea más anódico (se encuentre por debajo) que la energía de la base de la BC y que el potencial redox de un sustrato para ser oxidado (Pox) sea más catódico (esté por encima) que la energía del tope de la BV. Además, para que una reacción redox con ΔG > 0 proceda, a las anteriores restricciones se suma que las etapas de oxidación o reducción del sistema deben estar separadas espacialmente o químicamente. De esta manera, las diferencias de energía de Gibbs para las reacciones de e-con oxidantes (ΔGe) y de h+ con reductores (ΔGh) deben ser negativos, es decir que las reacciones de las especies fotogeneradas deben ser espontáneas una vez producida la fotoexcitación16. Esto se representa en el esquema de la figura 5.
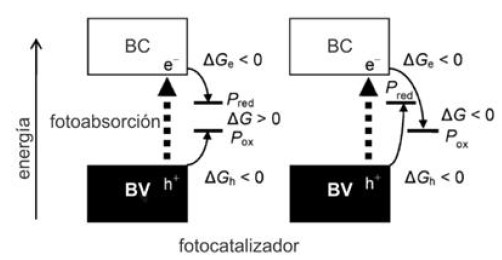
Fig. 5
Esquema del cambio de energía de Gibbs en reacciones fotocatalíticas17
Para un sistema que requiere el suministro de energía (ΔG > 0) como la hidrólisis fotocatalítica y fotoelectroquímica del agua para producir H2, es importante considerar la conversión de la energía luminosa en energía química. Para el caso de reacciones fotocatalíticas con ΔG < 0, la eficiencia de conversión no puede ser definida28. Existen al menos dos métodos para la determinación de la eficiencia: el basado en la cantidad molar, y el basado en la energía. Una explicación concreta sobre ambos métodos puede encontrarse en el trabajo de Ohtani15. Sobre esto, se debe resaltar que, respecto al método basado en la energía, dado que la determinación del número de fotones absorbidos en los materiales sólidos es compleja por la dispersión de los fotones incidentes, se prefiere emplear la eficiencia cuántica aparente (eficiencia fotónica) que considera el número de fotones incidentes y es el producto de las eficiencias de fotoabsorción y de utilización de e--h+. Estas eficiencias dependen tanto de la longitud de onda como de la intensidad de la irradiación. Por esto, las mediciones asociadas al cálculo de estas eficiencias deben realizarse con irradiación monocromática y no con filtros ópticos de corte15,34.
La figura 6 representa por separado las eficiencias de foto-absorción y de utilización de e- y h+ junto con la eficiencia cuántica aparente como resultado de las mismas. Este tipo de gráfico de la eficiencia cuántica aparente frente a la longitud de onda empleada para su medición se denomina espectro de acción y también puede expresarse como la velocidad de la reacción fotocatalítica o fotoquímica por unidad del número de fotones incidentes como función de la longitud de onda.
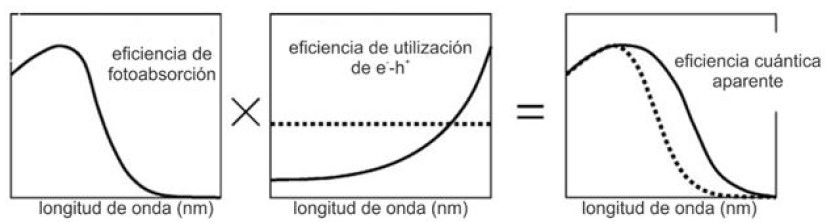
Fig. 6
Esquema representativo de las eficiencias de fotoabsorción, cuántica y cuántica aparente15
Los espectros de acción constituyen una herramienta de gran utilidad en la determinación de la capacidad de un material para conducir una reacción fotocatalítica35. Tal verificación normalmente se ha efectuado con experimentos control donde se examina la ocurrencia de la reacción en presencia del supuesto material fotocatalizador y el sustrato bajo fotoirradiación. Si la reacción sucede solo cuando los tres elementos participan, ha sido denominada fotocatalítica. Sin embargo, varios sistemas no fotocatalíticos también satisfacen esta verificación; tal es el caso de la descomposición fotoinducida de azul de metileno en una suspensión acuosa de TiO2. En este sistema, el azul de metileno adsorbido en la superficie del TiO2 absorbe luz visible, inyecta un electrón en la BC del TiO2 y es degradado. Consecuentemente, estos experimentos control no podrían discriminar si se trata o no de una reacción fotocatalítica y la única forma de conocer cuál es el ente que absorbe luz para inducir la reacción es a través del análisis del espectro de acción17,36. La figura 7 muestra los espectros de acción para el sistema del azul de metileno en presencia de S-TiO2 y P-25 (polvo comercial de TiO2), en línea entrecortada se incluyen los espectros de reflectancia difusa donde se puede constatar que el azul de metileno es la especie activa y responsable de la fotoabsorción en la región visible, entre 540-680 nm.
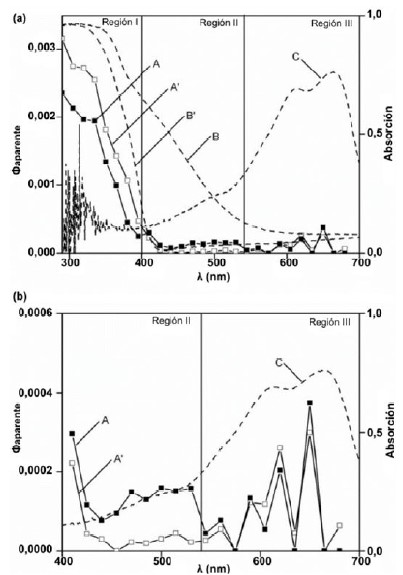
Fig. 7
Espectros de acción de la descomposición de azul de metileno en presencia de (A) TiO2 dopado con azufre, (A’) P-25 en (a) rango espectral completo y (b) región visible; espectros de reflectancia difusa de (B) TiO2 dopado con azufre, (B’) P-25; (C) azul de metileno34
Dopaje y modificaciones del TiO2
La aplicación de la fotocatálisis con TiO2 a escala industrial se ve limitada por la necesidad de emplear la a luz solar como fuente de irradiación24,27. El espectro de la irradiación solar incluye longitudes de onda en el rango de 28 80-4000 nm, del cual solo 3-5 % constituye luz ultravioleta con energía suficiente para el proceso de fotoexcitación sobre la superficie del TiO215.
Se han desarrollado varias estrategias para mejorar la actividad fotocatalítica del TiO2 bajo luz visible (λ > 400 nm), que equivale aproximadamente al 43 % del espectro de irradiación solar, lo cual también permitiría el uso de iluminación para interiores como fuente de fotoexcitación37. Las principales modificaciones son: implantación de iones metálicos38,39,40, síntesis de fotocatalizador reducido o TiOx41, dopaje con no metales42,43,44,45, formación de compuestos de TiO2 con semiconductores de banda prohibida menos ennergética8,46 o con metales nobles47,48, sensibilización con colorantes49,50 y modificación con tierras raras51,52,53. El objetivo de esta actualización es aclarar que el término “dopaje” ha sido ampliamente utilizado para expresar modificación en la estructura de un fotocatalizador; sin embargo, dopar consiste en alterar la estructura cristalina del material y no en un cambio superficial15. Para una explicación más detallada, se recomienda recurrir a las referencias incluidas en la breve explicación que se ofrece de las alternativas de modificación desarrolladas.
La modificación con no metales tiene tres diferentes perspectivas: disminución de la banda prohibida, niveles energéticos debidos a impurezas y oxígenos vacantes. Con respecto a la primera, Asahi et al.42 encontraron hibridaciones entre orbitales 2p del N con orbitales 2p del O en anatasa dopada con nitrógeno, lo que ocasionó una banda prohibida más estrecha para el N-TiO2 e hizo posible la absorción de luz visible. Por otro lado, Irie et al.54 indicaron que los sitios de oxígeno sustituidos por átomos de nitrógeno forman niveles energéticos de impurezas aislados sobre la BV, cuyos electrones pueden ser fotoexcitados por luz visible. Ihara et al.55 concluyeron que los oxígenos vacantes o deficiencia de oxígenos en los bordes de la partícula son importantes para permitir fotoactividad en presencia de luz visible mientras que el nitrógeno dopado en los sitios deficientes de oxígeno actúa como bloqueador de reoxidación.
El efecto del dopaje con metales se explica a través de un nuevo nivel energético en la banda prohibida del TiO2, ocasionado por las nanopartículas del metal en la matriz de TiO2. Esto se indica en la figura 8b, donde los electrones pueden ser excitados por fotones menos energéticos (hν3) que la banda prohibida del TiO2. Además, las nanopartículas metálicas pueden actuar como trampas para los electrones fotoinducidos y por tanto se evita la recombinación de e-y h+, lo que resulta en un incremento en la actividad fotocatalítica13,48.
Cuando se habla de modificar la superficie del fotocatalizador se emplea el término “decoración” y consiste en añadir nanopartículas de metales nobles, semiconductores o polímeros a la superficie de las nanoestructuras de TiO2. Los efectos esperados son: formación de una heterounión que cambia la flexión de banda del semiconductor o provee de niveles de energía aptos para la inyección de cargas, efecto fotocatalítico y mayor eficiencia para reacciones de transferencia de carga56,57.
Para la modificación con nanopartículas de metales nobles (Pt, Au, Ag, Pd), el mecanismo comprende la resonancia de plasmones superficiales de las partículas del metal por excitación bajo luz visible, lo que facilita tanto la excitación de los electrones superficiales como su transferencia a través de la interfase. Algunos niveles energéticos pueden hacerse presentes en la banda prohibida del TiO2. Además, las nanopartículas de los metales nobles actúan como trampas de electrones, lo que mejora la separación de los e- y h+ fotogenerados58.
La decoración puede también realizarse con semiconductores o sulfuros de banda prohibida angosta como CdS, CdSe, PbS, Bi2S3 que se depositan en la superficie. Los denominados puntos de CdS/CdSe tienen una banda prohibida de 2,0-2,4 eV por lo que pueden absorber luz visible e inyectar los electrones fotoexcitados rápidamente en la banda de conducción del TiO259,60.
Otra técnica bastante empleada es la sensibilización de la superficie del TiO2 con colorantes orgánicos y se basa en que, los electrones son ópticamente estimulados desde el HOMO (“highest occupied molecular orbital”) hacia el LUMO (“lowest occupied molecular orbital”) de la molécula orgánica y pueden inyectarse en la banda de conducción del TiO256,61.
Cada uno de los casos de modificación mencionados se encuentran representados en el esquema de la figura 8, donde se plantea el proceso fotoinducido tanto para el TiO2 puro, como para las estrategias de modificación.
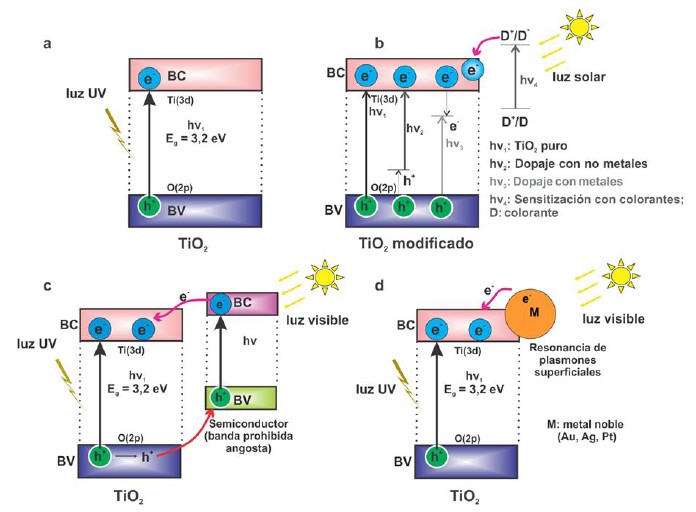
Fig. 8
Esquema del proceso fotoinducido en TiO2 puro y modificaciones: a) TiO2 puro, b) dopaje y sensibilización con colorantes, c) acoplado de semiconductores y d) acoplado de metales nobles57
Efecto de la cristalinidad en fotocatálisis
Los materiales empleados como fotocatalizadores son a menudo sólidos inorgánicos cristalinos, cuya estructura es usualmente caracterizada por difracción de rayos X, análisis que se vuelve muy complejo cuando las partículas son del tipo núcleo-coraza. Esta desventaja se agudiza debido a que existe la idea errónea de que los centros de recombinación se deben a “defectos de la red cristalina”. Como fue mencionado anteriormente, se ha propuesto que la recombinación tiene lugar a trampas de electrones del tipo profundas. Así, la hipótesis asumida, considera que las trampas superficiales y profundas incrementan y reducen la actividad fotocatalítica de las partículas, respectivamente; por migración de los electrones a través de la BC y trampas (superficiales) en el primer caso y por recombinación del par e--h+ en el segundo. Por esto, el diseño de fotocatalizadores con elevada actividad requiere el control preciso de las propiedades estructurales con una densidad maximizada de trampas superficiales y minimizada de trampas profundas29.
Ohtani et al.62 analizaron el comportamiento cristalino de las fases rutilo y anatasa aisladas del TiO2 comercial (P-25), al comparar la actividad fotocatalíca de dichas fases con la de TiO2 amorfo, P-25 y P-25 reconstituido en cuatro reacciones fotocatalíticas: descomposición oxidativa de ácido acético en disolución acuosa aireada, descomposición oxidativa de acetaldehído en aire, deshidrogenación de metanol en una disolución acuosa desairada y desprendimiento de oxígeno de una disolución acuosa de sulfato de plata. Los autores concluyeron que el mejoramiento de la actividad fotocatalítica puede obtenerse con el uso de la fase cristalina sea rutilo o anatasa dependiendo de la reacción que se pretende efectuar, además concluyeron que existe ausencia de un efecto sinérgico debido a la presencia de ambas fases en el P-25. Amano et al.63 y Sugishita et al.64 sintetizaron partículas decaédricas de anatasa con mayor actividad fotocatalítica que la del comercial P-25. Los autores atribuyeron esto a la combinación de gran área superficial específica y alto grado de cristalinidad (baja densidad de defectos cristalinos). Por otro lado, Ohtani et al.33 presentaron un análisis multivariable donde establecieron correlaciones de las actividades fotocatalíticas para cinco reacciones: liberación de oxígeno junto con deposición de plata, deshidrogenación de metanol, descomposición de ácido acético, descomposición de acetaldehído y síntesis de ácido pipecolínico de L-lisina con seis propiedades estructurales y físicas de 40 muestras comerciales de TiO2: área superficial específica, densidad de defectos cristalinos, tamaño de partícula primario y secundario, existencia de las fases rutilo y anatasa. Los autores demostraron la dependencia intrínseca de la actividad fotocatalítica con las propiedades del fotocatalizador. Sus resultados remarcaron que parámetros generalmente considerados como perjudiciales, tales como la densidad de defectos cristalinos, pueden resultar beneficiosos en ciertas reacciones, especialmente para aquellas en condiciones aireadas. Este estudio reportó que la elevada actividad fotocatalítica de las partículas decaédricas de anatasa no pudo ser reproducida por las ecuaciones de correlación obtenidas, lo que sugirió que otra propiedad no incluida, tal como la forma, podría tener influencia en la actividad de los fotocatalizadores. Recientemente, Janczarek et al.65 desarrollaron correlaciones entre los parámetros de preparación y las propiedades de las partículas decaédricas de anatasa (figura 9) para indicar las condiciones que permiten obtener dichas partículas con alto nivel fotocatalítico para los sistemas de reacción de descomposición oxidativa de ácido acético y deshidrogenación de metanol. Los autores remarcaron que tanto la forma como la heterogeneidad del tamaño de partícula influencian la fotoactividad.

Fig. 9
Imágenes SEM de las partículas de TiO2 anatasa decaédricas63
Por lo expuesto, no se puede dar una respuesta generalizada respecto a la condición cristalina que favorece la actividad fotocatalítica, sino que se deben analizar todas las propiedades del fotocatalizador en cada sistema en particular.
Síntesis de diferentes estructuras del TiO2 con capacidad fotocatalítica
En las últimas décadas ha habido un crecimiento exponencial en las actividades de investigación alrededor de nanomateriales, puesto que al disminuir el tamaño a la escala nano-métrica, nuevas propiedades físicas y químicas se hacen presentes. Dichas propiedades también son función de la forma de estos nanomateriales. Entre las propiedades más sobresalientes se tiene el movimiento de electrones y huecos gobernado por el confinamiento cuántico. Las propiedades de transporte están ampliamente afectadas por el tamaño y la geometría del material. La relación entre el área superficial específica y el volumen aumenta dramáticamente cuando el tamaño del material se reduce. Mayor área superficial se constituye benéfica pues facilita la reacción o interacción entre los dispositivos integrados por nanopartículas del fotocatalizador y el medio. Existen numerosos métodos desarrollados para la síntesis de nanoestructuras de TiO2 como nanopartículas, nanoplatos, nanocubos, nanoalambres, nanotubos, nanobarras, etc. y por tanto, numerosos reportes sobre su síntesis y actividad fotocatalítica han sido presentados, así como revisiones acerca de las técnicas empleadas11,60,66. Es así como, tan solo para el caso de películas porosas, la figura 10 presenta de manera esquematizada los diferentes métodos desarrollados hasta la actualidad.
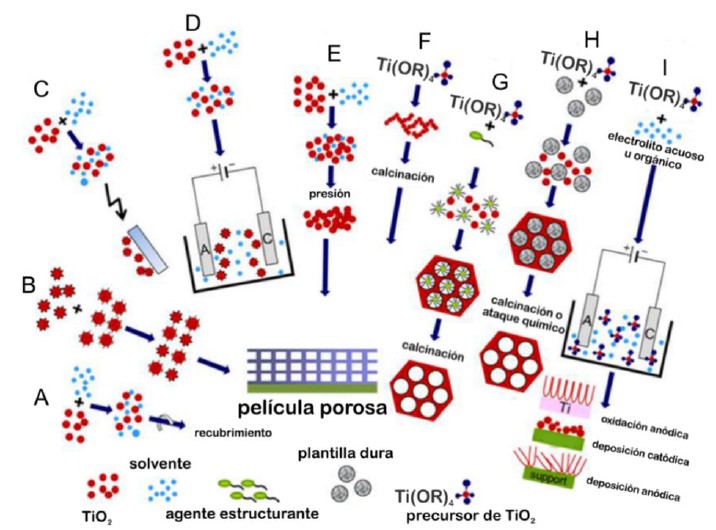
Fig. 10
Esquema de las diferentes estrategias de síntesis de películas porosas de TiO2. (A) Moldeo por fusión de especies de TiO2 preformadas; (B) deposición electrostática capa por capa; (C) técnica electrospray; (D) deposición electroforética; (E) proceso a baja temperatura; (F) proceso sol-gel; (G) auto ensamblaje por evaporación inducida; (H) técnica con plantilla de cristal coloidal y (I) técnicas electroquímicas11
Entre las técnicas empleadas para la síntesis de TiO2 nano-estructurado y nanotitanatos se tienen: hidrotermal67,68, sol-gel69,70, deposición química de vapor (CVD)71,72, deposición física de vapor (PVD)73,74,75, solvotermal76,77, electroquímica78,79,80,81, combustión de solución82,83, microemulsión84,85, micela86 y micela inversa87, flama de combustión-condensación química de vapor88,89, reacciones sonoquímicas90,91 y evaporación de plasma92,93.
Entre los métodos mencionados, los más exitosos son sol-gel, hidrotermal y electroquímico porque permiten un mayor control sobre la morfología, tamaño de partícula y la cristalinidad. El proceso sol-gel procede vía la hidrólisis catalizada por ácido de un precursor de titanio como alcóxido de titanio (IV), en presencia de una plantilla, seguido por polimerización de TiO2 en las moléculas de la auto-ensamblada plantilla o deposición de TiO2 en la superficie de los agregados de la plantilla. Posteriormente se remueve la plantilla y se calcina la muestra23. Por otro lado, el método hidrotermal emplea la solubilidad en agua de la mayoría de sustancias inorgánicas a elevadas temperaturas y presiones para inducir la cristalización del material disuelto desde el fluido. Se lleva a cabo usualmente en pequeños reactores de acero resistentes a la presión recubiertos de teflón con la reacción en solución acuosa66. Finalmente, la técnica electro-química (anodización electroquímica), también conocida como oxidación anódica, es el proceso de formación de un óxido sobre la superficie de un metal bajo la aplicación de una diferencia de potencial eléctrico a través de una celda electroquímica que consta de dos electrodos: el de trabajo o ánodo, que está constituido por el metal de interés, y el contraelectrodo o cátodo, en presencia de un electrolito. Esta oxidación puede efectuarse bajo voltaje o intensidad de corriente constante5. De esta manera, es posible obtener capas de óxido de diferentes características de acuerdo con el electrolito y con los parámetros particulares de anodización; lo que se presenta como un método simple y conveniente para la fabricación de capas uniformes de nanoestructuras verticalmente auto-ordenadas94,95.
Debe considerarse que la variación en las condiciones de síntesis conduce a la obtención de diferentes nanomorfologías; sin embargo, es de interés recalcar que aún no ha sido posible determinar qué parámetros estructurales gobiernan la actividad fotocatalítica y por tanto no se conoce claramente cómo el tamaño nano, o en otro rango, de los fotocatalizadores afecta por sí solo en la actividad de los mismos15.
Aplicaciones ambientales de nanoestructuras con actividad fotocatalítica
Los radicales producidos durante la fotocatálisis, tanto hidroxilo (•OH) como superóxido (O2•−) son de interés en aplicaciones de remediación ambiental puesto que son capaces de oxidar la materia orgánica a CO2 y H2O. De esta forma, se posibilita degradar sustancias tóxicas bioresistentes en aguas residuales, en emisiones gaseosas y suelos contaminados23,27,37.
Descontaminación de agua
En medio acuoso, la producción de radicales por medio del proceso fotocatalítico permite la degradación de contaminantes tanto inorgánicos como orgánicos. Los contaminantes inorgánicos no pueden ser removidos, pero sí detoxificados. Aniones de elementos como S, N, P, C, As etc., son oxidados a su máximo y no dañino estado de oxidación96,97. Metales pesados, así como metales nobles (Pb, Cr, Ag, Cu, Ni, Zn, entre otros) pueden ser removidos de efluentes industriales por fotoreducción como cristales pequeños depositados en un fotocatalizador98,99. Por otro lado, los contaminantes orgánicos constituyen el campo principal de aplicación para la descontaminación fotocatalítica; de esta forma, compuestos tóxicos biorresistentes tanto de naturaleza alifática como aromática pueden ser totalmente mineralizados a productos que dependiendo de la composición química del contaminante pueden ser de manera general CO2, sulfatos, nitrógeno, nitratos y H2O34. La oxidación de estos compuestos es no selectiva y se da por ataque del radical hidroxilo (OH) a los enlaces C-H lo que da paso a una serie de reacciones radicalarias100. Una amplia gama de compuestos orgánicos ha sido degradada fotocatalíticamente: fenoles y derivados7,101,102,103, herbicidas104, pesticidas105,106,107, fungicidas108,109, surfactantes110,111 y residuos farmacéuticos112,113,114 Colorantes115,116 también han sido empleados como contaminantes modelo. Sin embargo, en ausencia de espectros de acción reportados, no se puede afirmar una efectiva actividad fotocatalítica de los propuestos fotocatalizadores.
Las especies fotogeneradas en las reaccione es fotocatalíticas son también útiles para la desinfección. DDe esta forma, numerosos reportes han sido presentados sobre la inactivación tanto de virus como de bacterias. El c caso modelo más analizado ha sido Escherichia coli117,118, sin embargo se han presentado estudios de desactivación de coliformes119,120, Staphylococcus aureus121, Salmonella entéérica sero var Typhi122, virus de la influenza aviar H1N1123, entre otros.
Descontaminación de aire
La fotocatálisis no se restringe a aplicaciones en fase acuosa, sino que también es apreciable en reacciones en fase gaseosa. Generalmente, para este estudio, el fotocatalizador debe usarse en un lecho fijo, móvil o debe depositarse en un soporte fotoinerte100. De esta manera, los compuestos orgánicos volátiles (COVs) pueden ser mineralizados mediante reacciones fotocatalíticas; este proceso requiere la presencia de cierta cantidad de humedad en la superficie del fotocatalizador (TiO2) como fuente de radical hidroxilo. Esta hidratación se mantiene cuando la degradación empieza, debido a la oxidación de los enlaces C-H de los contaminantes. El tolueno es un compuesto modelo, entre los COVs, utilizado para las pruebas de fotoactividad en estudios sobre catalizadores8,46,80,124,125. La purificación de gases de escape es otra aplicación plausible de la fotocatálisis. Es posible la eliminación de NOx, CO, SOx del aire126,127; así como la prevención de emisiones de SOx al ambiente a través de la oxidación fotocatalítica desulfurativa de combustibles128.
Descontaminación de suelos
Los sistemas de fotocatálisis heterogénea también han resultado exitosos para la remediación de suelos contaminados con compuestos orgánicos como hidrocarburos aromáticos policíclicos129,130, Hamerski et al.131 trataron suelo contaminado con derivados del petróleo mediante fotocatálisis con TiO2 modificado con bario, potasio y calcio en presencia de luz solar con resultados bastante prometedores con un 37,6 % de descomposición para el fotocatalizador modificado con Ca(OH)2. Huang and Hong132 presentaron la efectiva fotodegradación de bifenilos policlorados en presencia de TiO2 como fotocatalizador. Compuestos haloaromáticos así como pesticidas han sido efectivamente removidos de suelos contaminados mediante oxidación fotocatalítica133.
La implementación industrial de estos procesos fotocatalíticos orientados a la remediación ambiental debe considerar la necesidad de usar irradiación solar junto con el diseño de fotorreactores que favorezca el contacto de la irradiación con la superficie del fotocatalizador, de tal manera que se asegure la mayor eficiencia para la reacción fotocatalítica. Aspectos como la regeneración y recuperación del fotocatalizador deben aún ser tratados y mejorados puesto que, durante la reacción fotocatalítica, la superficie del fotocatalizador puede saturarse con subproductos de la degradación, lo cual reduce el área superficial activa y puede afectar el desempeño del proceso a largo plazo. La combinación de esta tecnología con tratamientos biológicos es también otro aspecto a investigarse cuando se trata de efluentes con compuestos orgánicos refractarios a fin de incrementar la eficiencia depurativa del proceso biológico ya que, si éste es instalado luego del fotocatalítico, se puede disminuir el tiempo de residencia y el volumen de reacción; y, en conclusión, el costo de operación24.
Conclusiones
La revisión de los conceptos y fundamentos de la fotocatálisis permitió esclarecer este proceso, empezando por la diferencia entre este y el de catálisis, no solo con base en la existencia de sitios activos sino también en la termodinámica asociada a ambos procesos. Por otro lado, la descripción de las reacciones posibles en la superficie del TiO2 ha abierto el campo hacia la investigación sobre aplicaciones de interés ambiental ya sea a través de la generación de energías limpias como el H2, por hidrólisis del agua, o a través de la degradación de contaminantes. Sin embargo, la eficiencia de estas aplicaciones requiere mejorarse a través de estrategias de modificación de los fotocatalizadores existentes, para esto, es importante recordar que los parámetros que benefician ciertas reacciones pueden tener un efecto perjudicial en otras, y, por tanto, un análisis particular debe ser realizado. Debe recordarse que, la fotocatálisis no se limita a materiales semiconductores y que el modelo de bandas únicamente muestra una de las condiciones necesarias a las que la separación de las cargas: e-y h+ debe sumársele. Finalmente, el desarrollo de verdaderos fotocatalizadores exige a la comunidad científica su caracterización a través de espectros de acción, así como, evitar el uso de degradación de colorantes como reacción modelo para evaluar la eficiencia de un fotocatalizador.
Referencias
1. Q Guo, C Zhou, Z Ma, Z Ren, H Fan, X Yang. Fundamental Processes in Surface Photocatalysis on TiO2. in: J Colmenares, Y Xu (Eds.). Heterogeneous Photocatalysis. Green Chemistry and Sustainable Technology. Springer, Berlin, Heidelberg. Berlin. pp. 361-416 (2016).
2. D Robert, N Keller, E Selli. Environmental photocatalysis and photochemistry for a sustainable world: a big challenge. Environmental Science and Pollution Research International, 24, 12503-12505 (2017).
3. B Ohtani. Hidden but Possibly Fatal Misconceptions in Photocatalysis Studies: A Short Critical Review. Catalysts, 6, 192 (2016).
4. A Fujishima, K Honda. Electrochemical Photolysis of Water at a Semiconductor Electrode. Nature, 238, 37-38 (1972).
5. D Khudhair, A Bhatti, Y Li, HA Hamedani, H Garmestani, P Hodgson, S Nahavandi. Anodization parameters influencing the morphology and electrical properties of TiO2 nanotubes for living cell interfacing and investigations. Mater. Sci. Eng. C, 59, 1125-1142 (2016).
6. H Zhang, JF Banfield. Structural characteristics and mechanical and thermodynamic properties of nanocrystalline TiO2. Chem. Rev., 114, 9613-9644 (2014).
7. M Diak, M Klein, T Klimczuk, W Lisowski, H Remita, A Zaleska-Medynska, E Grabowska. Photoactivity of decahedral TiO2 loaded with bimetallic nanoparticles: Degradation pathway of phenol-1-13C and hydroxyl radical formation. Applied Catalysis B, 200, 56-71 (2017).
8. MC Nevárez-Martínez, P Mazierski, MP Kobylanski, G Szczepanska, G Trykowski, A Malankowska, M Kozak, PJ Espinoza-Montero, A Zaleska-Medynska. Growth, Structure, and Photocatalytic Properties of Hierarchical V2O5-TiO2 Nanotube Arrays Obtained from the One-step Anodic Oxidation of Ti-V Alloys. Molecules, 22(4), 580 (2017).
9. J Fu, B Zhu, W You, M Jaroniec, J Yu. A flexible bio-inspired H2-production photocatalyst. Applied Catalysis B, 220, 148-160 (2018).
10. X Sun, D Jiang, L Zhang, W Wang. Alkaline modified g-C3N4 photocatalyst for high selective oxide coupling of benzyl alcohol to benzoin. Applied Catalysis B, 220, 553-560 (2018).
11. D Fattakhova-Rohlfing, A Zaleska, T Bein. Three-dimensional titanium dioxide nanomaterials. Chem. Rev., 114, 9487-9558 (2014).
12. A Kubacka, M Fernández-García, G Colón. Advanced nanoarchitectures for solar photocatalytic applications. Chem. Rev., 112, 1555-1614 (2012).
13. A Zaleska. Doped-TiO2: A Review. Recent Patents on Engineering, 2, 157-164 (2008).
14. N Koprivanac, H Kusic. Hazardous Organic Pollutants in Colored Wastewaters. Nova. New York, US (2009).
15. B Ohtani. Photocatalysis A to Z—What we know and what we do not know in a scientific sense. Journal of Photochemistry and Photobiology C, 11, 157-178 (2010).
16. B Ohtani. Photocatalysis by inorganic solid materials: Revisiting its definition, concepts, and experimental procedures. Advances in Inorganic Chemistry, 63, 395-430. 63, 395-430 (2011).
17. B Ohtani. Revisiting the fundamental physical chemistry in heterogeneous photocatalysis: its thermodynamics and kinetics. Phys. Chem. Chem. Phys., 16, 1788-1797 (2014).
18. AV Vorontsov, IV Stoyanova, DV Kozlov, VI Simagina, EN Savinov. Kinetics of the Photocatalytic Oxidation of Gaseous Acetone over Platinized Titanium Dioxide. Journal of Catalysis, 189, 360-369 (2000).
19. ÖE Kartal, M Erol, H Ouz. Photocatalytic Destruction of Phenol by TiO2 Powders. Chemical Engineering & Technology, 24, 645-649 (2001).
20. DV Kozlov, AA Panchenko, DV Bavykin, EN Savinov, PG Smirniotis. Influence of humidity and acidity of the titanium dioxide surface on the kinetics of photocatalytic oxidation of volatile organic compounds. Russian Chemical Bulletin, 52, 1100-1105 (2003).
21. AEH Machado, JA de Miranda, RF de Freitas, ETFM Duarte, LF Ferreira, YDT Albuquerque, R Ruggiero, C Sattler, L de Oliveira. Destruction of the organic matter present in effluent from a cellulose and paper industry using photocatalysis. Journal of Photochemistry and Photobiology A, 155, 231-241 (2003).
22. X Ke, X Zhang, J Zhao, S Sarina, J Barry, H Zhu. Selective reductions using visible light photocatalysts of supported gold nanoparticles. Green Chem., 15, 236-244 (2013).
23. A Khataee, GA Mansoori. Nanostructured Titanium Dioxide Materials: Properties, Preparation and Applications. World Scientific Publishing Co. London, SG (2011).
24. R Daghrir, P Drogui, D Robert. Modified TiO2 For Environmental Photocatalytic Applications: A Review. Industrial & Engineering Chemistry Research, 52, 3581-3599 (2013).
25. X Chen, A Selloni. Introduction: titanium dioxide (TiO2) nanomaterials. Chem. Rev., 114, 9281-9282 (2014).
26. J Schneider, M Matsuoka, M Takeuchi, J Zhang, Y Horiuchi, M Anpo, DW Bahnemann. Understanding TiO2 photocatalysis: mechanisms and materials. Chem. Rev., 114, 9919-9986 (2014).
27. S Banerjee, SC Pillai, P Falaras, KE O'Shea, JA Byrne, DD Dionysiou. New Insights into the Mechanism of Visible Light Photocatalysis. J. Phys. Chem. Lett., 5, 2543-2554 (2014).
28. B Ohtani. Principle of Photocatalysis and Design of Active Photocatalysts. In: New and Future Developments in Catalysis, Chapter 5, pp.121-144, Elsevier (2013).
29. B Ohtani. Titania Photocatalysis beyond Recombination: A Critical Review. Catalysts, 3, 942-953 (2013).
30. JM Herrmann. Fundamentals and misconceptions in photocatalysis. J. Photochemistry and Photobiology A, 216, 85-93 (2010).
31. A Pfitzner, S Dankesreiter, A Eisenhofer, M Cherevatskaya. Heterogeneous semiconductor photocatalysis. in: B König (Ed.). Chemical Photocatalysis. De Gruyter. Berlin/Boston, DE (2013).
32. H Cheng, A Selloni. Surface and subsurface oxygen vacancies in anataseTiO2 and differences with rutile. Physical Review B, 79, (092101-1)-(092101-4) (2009).
33. B Ohtani, OO Prieto Mahaney, F Amano, N Murakami, R Abe. What Are Titania Photocatalysts? -An Exploratory Correlation of Photocatalytic Activity with Structural and Physical Properties. J. Advanced Oxidation Technologies, 13, 247-261 (2010).
34. H Kisch. Semiconductor Photocatalysis: Principles and Applications (1). Wiley-VCH. Somerset, DE (2014).
35. T Torimoto, Y Aburakawa, Y Kawahara, S Ikeda, B Ohtani. Light intensity dependence of the action spectra of photocatalytic reactions with anatase titanium(IV) oxide. Chemical Physics Letters, 392, 220-224 (2004).
36. X Yan, T Ohno, K Nishijima, R Abe, B Ohtani. Is methylene blue an appropriate substrate for a photocatalytic activity test? A study with visible-light responsive titania. Chemical Physics Letters, 429, 606-610 (2006).
37. WY Teoh, JA Scott, R Amal. Progress in Heterogeneous Photocatalysis: From Classical Radical Chemistry to Engineering Nanomaterials and Solar Reactors. J. Phys. Chem. Lett., 3, 629-639 (2012).
38. M Anpo. The design and development of highly reactive titanium oxide photocatalysts operating under visible light irradiation. Journal of Catalysis, 216, 505-516 (2003).
39. W Choi, A Termin, MR Hoffmann. The Role of Metal Ion Dopants in Quantum-Sized TiO2: Correlation between Photoreactivity and Charge Carrier Recombination Dynamics. The Journal of Physical Chemistry, 98, 13669-13679 (1994).
40. A Di Paola, G Marcì, L Palmisano, M Schiavello, K Uosaki, S Ikeda, B Ohtani. Preparation of Polycrystalline TiO2 Photocatalysts Impregnated with Various Transition Metal Ions:Characterization and Photocatalytic Activity for the Degradation of 4-Nitrophenol. The Journal of Physical Chemistry B, 106, 637-645 (2002).
41. F Zuo, L Wang, T Wu, Z Zhang, D Borchardt, P Feng. Self-Doped Ti3+ Enhanced Photocatalyst for Hydrogen Production under Visible Light. Journal of the American Chemical Society, 132, 11856-11857 (2010).
42. R Asahi, T Morikawa, T Ohwaki, K Aoki, Y Taga. Visiblelight photocatalysis in nitrogen-doped titanium oxides. Science, 293, 269-271 (2001).
43. TM Khedr, SM El-Sheikh, A Hakki, AA Ismail, WA Badawy, DW Bahnemann. Highly active non-metals doped mixedphase TiO2 for photocatalytic oxidation of ibuprofen under visible light. J. Photochemistry and Photobiology A, 346, 530-540 (2017).
44. MH Basha, NO Gopal, DB Nimbalkar, S-C Ke. Phosphorus and boron codoping into TiO2 nanoparticles; an avenue for enhancing the visible light photocatalytic activity. Journal of Materials Science: Materials in Electronics, 28, 987-993 (2016).
45. T Mondal, D Chatterjee. RuIII-edta (edta4−= ethylenediaminetetraacetate) mediated photocatalytic conversion of carbonate to formate over visible light irradiated non-metal doped TiO2 semiconductor photocatalysts. RSC Adv., 6, 63488-63492 (2016).
46. MC Nevárez-Martínez, MP Kobylanski, P Mazierski, J Wolkiewicz, G Trykowski, A Malankowska, M Kozak, PJ Espinoza-Montero, A Zaleska-Medynska. Self-Organized TiO2-MnO2 Nanotube Arrays for Efficient Photocatalytic Degradation of Toluene. Molecules, 22, (2017).
47. A Zielińska-Jurek, E Kowalska, JW Sobczak, W Lisowski, B Ohtani, A Zaleska. Preparation and characterization of monometallic (Au) and bimetallic (Ag/Au) modified-titania photocatalysts activated by visible light. Applied Catalysis B, 101, 504-514 (2011).
48. M Nischk, P Mazierski, Z Wei, K Siuzdak, NA Kouame, E Kowalska, H Remita, A Zaleska-Medynska. Enhanced photocatalytic, electrochemical and photoelectrochemical properties of TiO2 nanotubes arrays modified with Cu, AgCu and Bi nanoparticles obtained via radiolytic reduction. Applied Surface Science, 387, 89-102 (2016).
49. JS Lee, DI Won, WJ Jung, HJ Son, C Pac, SO Kang. Widely Controllable Syngas Production by a Dye-Sensitized TiO2 Hybrid System with ReI and CoIII Catalysts under Visible-Light Irradiation. Angew. Chem. Int. Ed. Engl., 56, 976-980 (2017).
50. N Lu, YP Yeh, GB Wang, TY Feng, YH Shih, D Chen. Dyesensitized TiO2-catalyzed photodegradation of sulfamethoxazole under blue or yellow light. Environmental Science and Pollution Eesearch International, 24, 489-499 (2017).
51. P Parnicka, P Mazierski, T Grzyb, Z Wei, E Kowalska, B Ohtani, W Lisowski, T Klimczuk, J Nadolna. Preparation and photocatalytic activity of Nd-modified TiO2 photocatalysts: Insight into the excitation mechanism under visible light. Journal of Catalysis, 353, 211-222 (2017).
52. P Mazierski, W Lisowski, T Grzyb, MJ Winiarski, T Klimczuk, A Mikołajczyk, J Flisikowski, A Hirsch, A Kołakowska, T Puzyn, A Zaleska-Medynska, J Nadolna. Enhanced photocatalytic properties of lanthanide-TiO 2 nanotubes: An experimental and theoretical study. Applied Catalysis B, 205, 376-385 (2017).
53. J Reszczyńska, T Grzyb, Z Wei, M Klein, E Kowalska, B Ohtani, A Zaleska-Medynska. Photocatalytic activity and luminescence properties of RE3+–TiO2 nanocrystals prepared by sol–gel and hydrothermal methods. Applied Catalysis B, 181, 825-837 (2016).
54. H Irie, Y Watanabe, K Hashimoto. Nitrogen-Concentration Dependence on Photocatalytic Activity of TiO2-xNx Powders. The Journal of Physical Chemistry B, 107, 5483-5486 (2003).
55. T Ihara, M Miyoshi, Y Iriyama, O Matsumoto, S Sugihara. Visible-light-active titanium oxide photocatalyst realized by an oxygen-deficient structure and by nitrogen doping. Applied Catalysis B, 42, 403-409 (2003).
56. P Roy, S Berger, P Schmuki. TiO2 nanotubes: synthesis and applications. Angew Chem. Int. Ed. Engl., 50, 2904-2939 (2011).
57. J Huang, K Zhang, Y Lai. Recent Advances in Synthesis, Modification and Applications of TiO2 Nanotube Arrays by Electrochemical Anodization. in: M Aliofkhazraei, HAS Makhlouf (Eds.). Handbook of Nanoelectrochemistry: Electrochemical Synthesis Methods, Properties and Characterization Techniques. Springer International Publishing. Cham. pp. 1-33 (2016).
58. M Diak, E Grabowska, A Zaleska. Synthesis, characterization and photocatalytic activity of noble metal-modified TiO2 nanosheets with exposed {001} facets. Applied Surface Science, 347, 275-285 (2015).
59. A Kongkanand, K Tvrdy, K Takechi, M Kuno, PV Kamat. Quantum Dot Solar Cells. Tuning Photoresponse through Size and Shape Control of CdSe−TiO2 Architecture. Journal of the American Chemical Society, 130, 4007-4015 (2008).
60. L Sang, Y Zhao, C Burda. TiO2 nanoparticles as functional building blocks. Chem. Rev., 114, 9283-9318 (2014).
61. T Bak, J Nowotny, NJ Sucher, E Wachsman. Effect of Crystal Imperfections on Reactivity and Photoreactivity of TiO2(Rutile) with Oxygen, Water, and Bacteria. The Journal of Physical Chemistry C, 115, 15711-15738 (2011).
62. B Ohtani, OO Prieto-Mahaney, D Li, R Abe. What is Degussa (Evonik) P25? Crystalline composition analysis, reconstruction from isolated pure particles and photocatalytic activity test. Journal of Photochemistry and Photobiology A, 216, 179-182 (2010).
63. F Amano, O-O Prieto-Mahaney, Y Terada, T Yasumoto, T Shibayama, B Ohtani. Decahedral Single-Crystalline Particles of Anatase Titanium(IV) Oxide with High Photocatalytic Activity. Chemistry of Materials, 21, 2601-2603 (2009).
64. N Sugishita, Y Kuroda, B Ohtani. Preparation of decahedral anatase titania particles with high-level photocatalytic activity. Catalysis Today, 164, 391-394 (2011).
65. M Janczarek, E Kowalska, B Ohtani. Decahedral-shaped anatase titania photocatalyst particles: Synthesis in a newly developed coaxial-flow gas-phase reactor. Chemical Engineering Journal, 289, 502-512 (2016).
66. X Chen, SS Mao. Titanium Dioxide Nanomaterials:Synthesis, Properties, Modifications, and Applications. Chemical Reviews, 107, 2891-2959 (2007).
67. Z Li, B Hou, Y Xu, D Wu, Y Sun. Hydrothermal synthesis, characterization, and photocatalytic performance of silicamodified titanium dioxide nanoparticles. J. Colloid Interface Sci., 288, 149-154 (2005).
68. J Tao, Z Gong, G Yao, Y Cheng, M Zhang, J Lv, S Shi, G He, X Chen, Z Sun. Hydrothermal growth of nanorod arrays and in situ conversion to nanotube arrays for highly efficient Agsensitized photocatalyst. J. Alloys and Compounds, 689, 451-459 (2016).
69. SA Amin, M Pazouki, A Hosseinnia. Synthesis of TiO2–Ag nanocomposite with sol–gel method and investigation of its antibacterial activity against E. coli. Powder Technology, 196, 241-245 (2009).
70. CM Malengreaux, SL Pirard, G Léonard, JG Mahy, M Herlitschke, B Klobes, R Hermann, B Heinrichs, JR Bartlett. Study of the photocatalytic activity of Fe3+, Cr3+, La3+ and Eu3+ single-doped and co-doped TiO2 catalysts produced by aqueous sol-gel processing. J. Alloys and Compounds, 691, 726-738 (2017).
71. S Klosek, D Raftery. Visible Light Driven V-Doped TiO2 Photocatalyst and Its Photooxidation of Ethanol. The Journal of Physical Chemistry B, 105, 2815-2819 (2001).
72. H Lee, MY Song, J Jurng, Y-K Park. The synthesis and coating process of TiO2 nanoparticles using CVD process. Powder Technology, 214, 64-68 (2011).
73. C Giolli, F Borgioli, A Credi, AD Fabio, A Fossati, MM Miranda, S Parmeggiani, G Rizzi, A Scrivani, S Troglio, A Tolstoguzov, A Zoppi, U Bardi. Characterization of TiO2 coatings prepared by a modified electric arc-physical vapour deposition system. Surface and Coatings Technology, 202, 13-22 (2007).
74. HR Bakhsheshi-Rad, E Hamzah, M Daroonparvar, SN Saud, MR Abdul-kadir. Bi-layer nano-TiO2/FHA composite coatings on Mg–Zn–Ce alloy prepared by combined physical vapour deposition and electrochemical deposition methods. Vacuum, 110, 127-135 (2014).
75. I Apostol, KV Saravanan, CJA Monty, PM Vilarinho. Solar physical vapor deposition: A new approach for preparing magnesium titanate nanopowders. Applied Surface Science, 285, 49-55 (2013).
76. M Paszkiewicz, J Łuczak, W Lisowski, P Patyk, A Zaleska-Medynska. The ILs-assisted solvothermal synthesis of TiO2 spheres: The effect of ionic liquids on morphology and photoactivity of TiO2. Applied Catalysis B, 184, 223-237 (2016).
77. RK Wahi, Y Liu, JC Falkner, VL Colvin. Solvothermal synthesis and characterization of anatase TiO2 nanocrystals with ultrahigh surface area. J. Colloid Interface Sci., 302, 530-536 (2006).
78. JM Macak, P Schmuki. Anodic growth of self-organized anodic TiO2 nanotubes in viscous electrolytes. Electrochimica Acta, 52, 1258-1264 (2006).
79. H Jha, R Hahn, P Schmuki. Ultrafast oxide nanotube formation on TiNb, TiZr and TiTa alloys by rapid breakdown anodization. Electrochimica Acta, 55, 8883-8887 (2010).
80. M Nischk, P Mazierski, M Gazda, A Zaleska. Ordered TiO2 nanotubes: The effect of preparation parameters on the photocatalytic activity in air purification process. Applied Catalysis B, 144, 674-685 (2014).
81. P Mazierski, M Nischk, M Gołkowska, W Lisowski, M Gazda, MJ Winiarski, T Klimczuk, A Zaleska-Medynska. Photocatalytic activity of nitrogen doped TiO2 nanotubes prepared by anodic oxidation: The effect of applied voltage, anodization time and amount of nitrogen dopant. Applied Catalysis B, 196, 77-88 (2016).
82. G Sivalingam, MH Priya, G Madras. Kinetics of the photodegradation of substituted phenols by solution combustion synthesized TiO2. Applied Catalysis B, 51, 67-76 (2004).
83. X Ma, L Xue, X Li, M Yang, Y Yan. Controlling the crystalline phase of TiO2 powders obtained by the solution combustion method and their photocatalysis activity. Ceramics International, 41, 11927-11935 (2015).
84. T Mishra. Anion supported TiO2–ZrO2 nanomaterial synthesized by reverse microemulsion technique as an efficient catalyst for solvent free nitration of halobenzene. Catalysis Communications, 9, 21-26 (2008).
85. M Sanchez-Dominguez, G Morales-Mendoza, MJ Rodriguez-Vargas, CC Ibarra-Malo, AA Rodriguez-Rodriguez, AV Vela-Gonzalez, SA Perez-Garcia, R Gomez. Synthesis of Zn-doped TiO2 nanoparticles by the novel oil-in-water (O/W) microemulsion method and their use for the photocatalytic degradation of phenol. Journal of Environmental Chemical Engineering, 3, 3037-3047 (2015).
86. L He, L Chen, Y Zhao, W Chen, C Shan, Z Su, E Wang. TiO2 film decorated with highly dispersed polyoxometalate nanoparticles synthesized by micelle directed method for the efficiency enhancement of dye-sensitized solar cells. Journal of Power Sources, 328, 1-7 (2016).
87. X Sui, Y Chu, S Xing, M Yu, C Liu. Self-organization of spherical PANI/TiO2 nanocomposites in reverse micelles. Colloids and Surfaces A, 251, 103-107 (2004).
88. BK Kim, GG Lee, HM Park, NJ Kim. Characteristics of nanostructured TiO2 powders synthesized by combustion flame-chemical vapor condensation process. Nanostructured Materials, 12, 637-640 (1999).
89. YJ Chen, MC Hsu, YC Cai. Preparation of TiO2 films using nanopowder synthesized by flat-flame chemical vapor condensation method for DSSCs. Journal of Alloys and Compounds, 490, 493-498 (2010).
90. W Guo, Z Lin, X Wang, G Song. Sonochemical synthesis of nanocrystalline TiO2 by hydrolysis of titanium alkoxides. Microelectronic Engineering, 66, 95-101 (2003).
91. SA Singh, G Madras. Sonochemical synthesis of Pt, Ru doped TiO2 for methane reforming. Applied Catalysis A, 518, 102-114 (2016).
92. T Miyata, S Tsukada, T Minami. Preparation of anatase TiO2 thin films by vacuum arc plasma evaporation. Thin Solid Films, 496, 136-140 (2006).
93. Y-c Pan, J-x Zou, X-q Zeng, W-j Ding. Hydrogen storage properties of Mg–TiO2 composite powder prepared by arc plasma method. Transactions of Nonferrous Metals Society of China, 24, 3834-3839 (2014).
94. A Sacco, A Lamberti, S Bianco, E Tresso. Anodically Grown TiO2 Nanotube Membranes: Synthesis, Characterization, and Application in Dye-Sensitized Solar Cells. in: M Aliofkhazraei, HAS Makhlouf (Eds.). Handbook of Nanoelectrochemistry: Electrochemical Synthesis Methods, Properties and Characterization Techniques. Springer International Publishing. Cham. pp. 1-23 (2016).
95. JM Macak, H Tsuchiya, A Ghicov, K Yasuda, R Hahn, S Bauer, P Schmuki. TiO2 nanotubes: Self-organized electrochemical formation, properties and applications. Current Opinion in Solid State and Materials Science, 11, 3-18 (2007).
96. L Xie, P Liu, Z Zheng, S Weng, J Huang. Morphology engineering of V2O5/TiO2 nanocomposites with enhanced visible light-driven photofunctions for arsenic removal. Applied Catalysis B: Environmental, 184, 347-354 (2016).
97. SN Frank, AJ Bard. Heterogeneous photocatalytic oxidation of cyanide ion in aqueous solutions at titanium dioxide powder. Journal of the American Chemical Society, 99, 303-304 (1977).
98. MR Samarghandi, J Nouri, AR Mesdaghinia, AH Mahvi, S Nasseri, F Vaezi. Efficiency removal of phenol, lead and cadmium by means of UV/TiO2/H2O2 processes. International Journal of Environmental Science & Technology, 4, 19-25 (2007).
99. K Kabra, R Chaudhary, RL Sawhney. Solar photocatalytic removal of Cu(II), Ni(II), Zn(II) and Pb(II): speciation modeling of metal-citric acid complexes. J Hazard Mater, 155, 424-432 (2008).
100. JM Herrmann, M Lacroix. Environmental photocatalysis in action for green chemistry. Kinetics and Catalysis, 51, 793-800 (2010).
101. A Turki, C Guillard, F Dappozze, Z Ksibi, G Berhault, H Kochkar. Phenol photocatalytic degradation over anisotropic TiO2 nanomaterials: Kinetic study, adsorption isotherms and formal mechanisms. Applied Catalysis B: Environmental, 163, 404-414 (2015).
102. P Mazierski, A Malankowska, M Kobylański, M Diak, M Kozak, MJ Winiarski, T Klimczuk, W Lisowski, G Nowaczyk, A Zaleska-Medynska. Photocatalytically active TiO2/Ag2O nanotube arrays interlaced with silver nanoparticles obtained from the one-step anodic oxidation of Ti–Ag alloys. ACS Catalysis, (2017).
103. E Grabowska, J Reszczynska, A Zaleska. Mechanism of phenol photodegradation in the presence of pure and modifiedTiO2: A review. Water research, 46, 5453-5471 (2012).
104. C Berberidou, V Kitsiou, E Kazala, DA Lambropoulou, A Kouras, CI Kosma, TA Albanis, I Poulios. Study of the decomposition and detoxification of the herbicide bentazon by heterogeneous photocatalysis: Kinetics, intermediates and transformation pathways. Applied Catalysis B: Environmental, 200, 150-163 (2017).
105. S Ahmed, MG Rasul, R Brown, MA Hashib. Influence of parameters on the heterogeneous photocatalytic degradation of pesticides and phenolic contaminants in wastewater: a short review. J Environ Manage, 92, 311-330 (2011).
106. AC Affam, M Chaudhuri. Degradation of pesticides chlorpyrifos, cypermethrin and chlorothalonil in aqueous solution by TiO2 photocatalysis. J Environ Manage, 130, 160-165 (2013).
107. J Arana, ICC Garriga, C Fernandez Rodriguez, JA Herrera Melian, JA Ortega Mendez, JM Dona Rodriguez, J Perez Pena. Combining TiO2-photocatalysis and wetland reactors for the efficient treatment of pesticides. Chemosphere, 71, 788-794 (2008).
108. M Jiménez-Tototzintle, I Oller, A Hernández-Ramírez, S Malato, MI Maldonado. Remediation of agro-food industry effluents by biotreatment combined with supported TiO2/H2O2 solar photocatalysis. Chemical Engineering Journal, 273, 205-213 (2015).
109. N Stamatis, M Antonopoulou, I Konstantinou. Photocatalytic degradation kinetics and mechanisms of fungicide tebuconazole in aqueous TiO2 suspensions. Catalysis Today, 252, 93-99 (2015).
110. A Hinkova, S Henke, Z Bubnik, V Pour, A Salova, M Slukova, E Sarka. Degradation of Food industrial pollutants by photocatalysis with immobilized titanium dioxide. Innovative Food Science & Emerging Technologies, 27, 129-135 (2015).
111. Z Zsilák, E Szabó-Bárdos, O Fónagy, O Horváth, K Horváth, P Hajós. Degradation of benzenesulfonate by heterogeneous photocatalysis combined with ozonation. Catalysis Today, 230, 55-60 (2014).
112. RL Fernández, JA McDonald, SJ Khan, P Le-Clech. Removal of pharmaceuticals and endocrine disrupting chemicals by a submerged membrane photocatalysis reactor (MPR). Separation and Purification Technology, 127, 131-139 (2014).
113. J Carbajo, M Jiménez, S Miralles, S Malato, M Faraldos, A Bahamonde. Study of application of titania catalysts on solar photocatalysis: Influence of type of pollutants and water matrices. Chemical Engineering Journal, 291, 64-73 (2016).
114. M Pazoki, M Parsa, R Farhadpour. Removal of the hormones dexamethasone (DXM) by Ag doped on TiO2 photocatalysis. Journal of Environmental Chemical Engineering, 4, 4426-4434 (2016).
115. S Wang, Y Guan, L Wang, W Zhao, H He, J Xiao, S Yang, C Sun. Fabrication of a novel bifunctional material of BiOI/Ag3VO4 with high adsorption–photocatalysis for efficient treatment of dye wastewater. Applied Catalysis B, 168-169, 448-457 (2015).
116. AR Khataee, MB Kasiri. Photocatalytic degradation of organic dyes in the presence of nanostructured titanium dioxide: Influence of the chemical structure of dyes. J. Molecular Catalysis A, 328, 8-26 (2010).
117. D Sethi, N Jada, A Tiwari, S Ramasamy, T Dash, S Pandey. Photocatalytic destruction of Escherichia coli in water by V2O5/TiO2. J. Photochem. Photobiol. B, 144, 68-74 (2015).
118. C Guo, K Wang, S Hou, L Wan, J Lv, Y Zhang, X Qu, S Chen, J Xu. H2O2 and/or TiO2 photocatalysis under UV irradiation for the removal of antibiotic resistant bacteria and their antibiotic resistance genes. J. Hazard., Mater., 323, 710-718 (2017).
119. L Rizzo. Inactivation and injury of total coliform bacteria after primary disinfection of drinking water by TiO2 photocatalysis. J. Hazard. Mater., 165, 48-51 (2009).
120. RB Dominguez-Espindola, JC Varia, A Alvarez-Gallegos, ML Ortiz-Hernandez, JL Pena-Camacho, S Silva-Martinez. Photoelectrocatalytic inactivation of fecal coliform bacteria in urban wastewater using nanoparticulated films of TiO2 and TiO2/Ag. Environmental Technology, 38, 606-614 (2017).
121. J Podporska-Carroll, A Myles, B Quilty, DE McCormack, R Fagan, SJ Hinder, DD Dionysiou, SC Pillai. Antibacterial properties of F-doped ZnO visible light photocatalyst. J. Hazard Mater., 324A, 39-47 (2015).
122. SJ Teh, SL Yeoh, KM Lee, CW Lai, SB Abdul Hamid, KL Thong. Effect of reduced graphene oxide-hybridized ZnO thin films on the photoinactivation of Staphylococcus aureus and Salmonella enterica serovar Typhi. J. Photochem. Photobiol. B, 161, 25-33 (2016).
123. K Takehara, K Yamazaki, M Miyazaki, Y Yamada, S Ruenphet, A Jahangir, D Shoham, M Okamura, M Nakamura. Inactivation of avian influenza virus H1N1 by photocatalyst under visible light irradiation. Virus Res., 151, 102-103 (2010).
124. A Zielińska-Jurek, A Zaleska. Ag/Pt-modified TiO2 nanoparticles for toluene photooxidation in the gas phase. Catalysis Today, 230, 104-111 (2014).
125. P Mazierski, J Nadolna, W Lisowski, MJ Winiarski, M Gazda, M Nischk, T Klimczuk, A Zaleska-Medynska. Effect of irradiation intensity and initial pollutant concentration on gas phase photocatalytic activity of TiO2 nanotube arrays. Catalysis Today, (2016).
126. L Liao, S Heylen, SP Sree, B Vallaey, M Keulemans, S Lenaerts, MBJ Roeffaers, JA Martens. Photocatalysis assisted simultaneous carbon oxidation and NOx reduction. Applied Catalysis B, 202, 381-387 (2017).
127. Y Boyjoo, H Sun, J Liu, VK Pareek, S Wang. A review on photocatalysis for air treatment: From catalyst development to reactor design. Chemical Engineering Journal, 310, 537-559 (2017).
128. X Lu, X Li, J Qian, N Miao, C Yao, Z Chen. Synthesis and characterization of CeO2/TiO2 nanotube arrays and enhanced photocatalytic oxidative desulfurization performance. J. Alloys and Compounds, 661, 363-371 (2016).
129. D Dong, P Li, X Li, C Xu, D Gong, Y Zhang, Q Zhao, P Li. Photocatalytic degradation of phenanthrene and pyrene on soil surfaces in the presence of nanometer rutile TiO2 under UVirradiation. Chemical Engineering Journal, 158, 378-383 (2010).
130. L Zhang, P Li, Z Gong, X Li. Photocatalytic degradation of polycyclic aromatic hydrocarbons on soil surfaces using TiO2 under UV light. J. Hazard. Mater., 158, 478-484 (2008).
131. M Hamerski, J Grzechulska, AW Morawski. Photocatalytic purification of soil contaminated with oil using modified TiO2 powders. Solar Energy, 66, 395-399 (1999).
132. Q Huang, C-S Hong. TiO2 photocatalytic degradation of PCBs in soil-water systems containing fluoro surfactant. Chemosphere, 41, 871-879 (2000).
133. E Pelizzetti, C Minero, V Carlin, E Borgarello. Photocatalytic soil decontamination. Chemosphere, 25, 343-351 (1992).